某化学学习小组在实验室中探究铁钉与热浓硫酸的反应。其探究流程如图所示: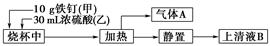
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”)。
(2)根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(3)上述流程图中从“静置”后的混合物中得到上清液B不能采用过滤的操作方法,其原因是__________________________________。
由于铁钉生锈,上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(4)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是________________(用化学方程式表示)。
利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是________(填仪器的字母代号),装置A的作用是____________________________,装置B中试剂X的化学式是________。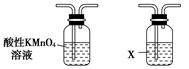
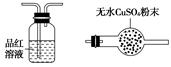
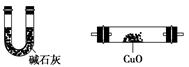
A B C D E F
(18分)实验室需要0.1 mol·L-1 NAOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: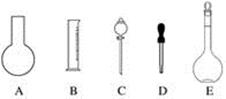
(1)如图所示的仪器中配制溶液肯定不需要的是____________________(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称)。
(2)在配制NAOH溶液时:
①根据计算用托盘天平称取NAOH的质量为________g;
②若NAOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NAOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度_____(填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·Cm-3的浓硫酸的体积为____(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________。
在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是(填化学式),反应的化学方程式为。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液,说明这种气体具有性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:。
(5)能否用澄清石灰水鉴别这两种气体?(填“能”或“不能”),若不能,请填写两种能鉴别的试剂。
在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置制取乙酸乙酯。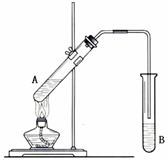
(1)试管B中盛放的溶液是,
其作用是:_________________________
导管末端不能插入试管B溶液液面以下的原因______________________________________________
(2)乙醇与乙酸反应的化学方程式是:_________________________
(3)实验完成后,试管B内液体分为两层,其中无色透明油状液体位于 __________层(填“上”或“下”)。若分离B中的液体混合物需要用到的玻璃仪器主要是。
我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓(晶体)
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。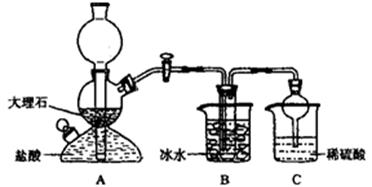
(1)A装置中所发生反应的离子方程式为________。C装置中稀硫酸的作用为_________。
(2)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(3)过滤NaHCO3时除烧杯、漏斗外,还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的晶体的质量为5.04g,则NaHCO3的产率为。
(12分)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算③溶解 ④摇匀 ⑤转移
⑥洗涤⑦定容 ⑧冷却 ⑨振荡
其正确的操作顺序为______________。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、____________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为______g,要完成本实验该同学应称出______g NaOH。
(3)使用容量瓶前必须进行的一步操作是______。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是______。
| A.转移溶液时不慎有少量洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线 |