几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )
| 元素 代号 |
X |
Y |
Z |
L |
M |
Q |
| 原子半 径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.077 |
0.074 |
| 主要 化合价 |
+2 |
+3 |
+6、 -2 |
+7、 -1 |
+4、 -4 |
-2 |
A.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
下列操作或仪器的选用正确的是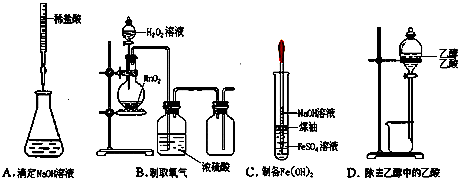
下列表述正确的是
A.比例模型为: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 |
B.2CH3CH2OD+O2 2CH3CHO+2DHO 2CH3CHO+2DHO |
| C.二氧化硫、氨、煤的液化均为物理变化 |
D.实验室中制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5 CH3COOC2H5+H218O CH3COOC2H5+H218O |
下列关于有机物的说法中不正确的是
| A.乙烯、苯、乙酸分子中的所有原子都在同一平面上 |
| B.正丁烷和异丁烷的熔、沸点不相同 |
| C.C4H9Br的同分异构体有4种 |
| D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
| A.N5+离子中含有36个电子 | B.O2与O4属于同位素 |
| C.C60是有机物 | D.H2与H3属于同种元素组成的单质 |
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确是
| A.标准状况下,反应过程中得到6.72L的气体 |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8 g的沉淀 |
| D.最终得到的溶液中c(Na+)=1.5 mol·L-1 |