用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.100 mL 1 mol·L-1AlCl3溶液中含阳离子数为0.1NA |
| B.标准状况下,1 L液态水中含有10-7NA个H+ |
| C.一定温度下,1 L 0.5 mol·L-1NH4Cl溶液有aNA个NH4+,2 L 0.25 mol·L-1NH4Cl溶液有bNA个NH4+,则a>b |
| D.2 mol SO2和1 mol O2混合在盛有V2O5的密闭容器中加热反应后,容器内物质分子数等于2NA |
下列说法正确的是()
| A.氯化钾溶液在电流作用下电离成钾离子和氯离子 |
| B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质 |
| C.硫酸钡难溶于水,所以硫酸钡属弱电解质 |
| D.纯净的强电解质在液态时,有的导电有的不导电 |
某种气态烃的混合物1L,完全燃烧后生成相同条件下的CO21.4L,水蒸气2L,则原气态混合物的组成不可能为()
| A.甲烷、乙烷和乙烯 | B.甲烷和乙烯 |
| C.甲烷、乙烷和乙炔 | D.甲烷、乙烯和丙炔 |
某优质甜樱桃中含有一种羟基酸(用M表示),M的碳链结构无支链,分子式为C4H6O5;1.34gM与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448L。M在一定条件下可发生如下转化: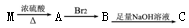 (M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是()
(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是()
A.M的结构简式为HOOC—CHOH—CH2—COOH
B.B的分子式为C4H4O4Br2
C.与M的官能团种类、数量完全相同的同分异构体还有1种
D.C物质可能溶于水
下列分子中的14个碳原子不可能处在同一平面上的是( )
已知乙烯分子是平面结构,因此1,2二氯乙烯可以形成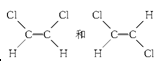
两种不同的空间异构体。下列各物质中,能形成类似上述两种空间异构体的是( )
| A.1丁烯 | B.丙烯 | C.2甲基2丁烯 | D.2氯2丁烯 |