现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外。这种气袋内装有一种能在高温下分解出气体的混合物。例如有一种配方为:
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“ 消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方 里哪些物质和起什么作用 。
里哪些物质和起什么作用 。
(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K) L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为 L。
(3)配方中Fe2O3的量是如何控制的 。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式 。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸 。
有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为 。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为 。
。
(1)CH3CH=CHCH3的名称为,其所含官能团的结构式为,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为。
(2)完成下列反应方程式,产物用键线式表示: +Br2→,反应类型为反应。
+Br2→,反应类型为反应。
(3) 是一种加聚产物,则其单体的结构简式为,其链节为。
是一种加聚产物,则其单体的结构简式为,其链节为。
(4)写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式。(任写一种)
高纯二氧化硅可用来制造光纤。某稻壳灰的成分为:
| 组分 |
SiO2 |
C |
Na2O |
K2O |
Al2O3 |
Fe2O3 |
| 质量分数 |
59.20 |
38.80 |
0.25 |
0.50 |
0.64 |
0.61 |
通过如下流程可由稻壳灰制备较纯净的二氧化硅。
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有类。
(2)步骤①中涉及SiO2的离子反应方程式为 。
(3)滤渣A的成分有(填化学式)
(4)步骤③反应的化学方程式为:;
(5)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、和。
某溶液可能含有K+、Mg2+、Al3+、Cl2、SO42-、S2-、NO3-中的几种,为确定溶液中的微粒种类,进行如下实验:
①通过观察,发现溶液呈浅黄绿色;
②取少许原溶液,滴加NaOH溶液直至过量,发现先有沉淀生成,后沉淀减少但并不完全消失;
③取少许原溶液,滴加BaCl2溶液,无白色沉淀生成。
请根据上述信息回答下列问题:
(1)原溶液中肯定存在上述微粒中的________________,肯定不存在的微粒有_______________。
(2)不能确定是否存在上述微粒中的______________________,确定其是否存在的实验方法是____________________(不要求写具体操作过程)。
(3)若步骤②中得到沉淀的最大质量为9.7g,最终剩余沉淀质量为5.8g,据此步骤可确定原溶液中一定存在的微粒的物质的量之比为____________________。
(4)下列离子还可以在原溶液中大量共存的是___________(填字母)。
| A.OH- | B.Fe2+ | C.NH4+ | D.CO32- |
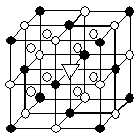
金属镁是六方最密堆积,金属铜是面心立方最密堆积,下图分别给出它们的堆积状况和晶胞示意图,它们空间利用率相同,假定镁、铜原子均为刚性小球,已知球的半径分别为R1厘米、R2厘米,阿伏伽德罗常数NA
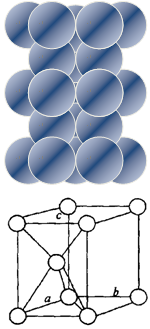 |
(1)镁原子在二维空间的配位数为 |
| (2)位于晶胞中部的鎂原子与离它最近两平面 (填“相离”或“相切”或”相交”) |
|
| (3)请用含R1、NA的数学式子表达金属镁的密度: g/cm3(根号带在分子上) |
|
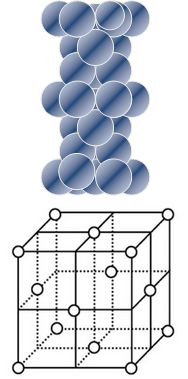 |
(4)铜原子在三维空间的配位数为 |
| (5)晶胞中面心上的六个铜原子构成的空间几何体名称为 |
|
| (6)请用含R2、NA的数学式子表达金属铜的密度: g/cm3(根号带在分子上) |
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)反应物A的化学式为,属于晶体。
(2)生成物中由分子组成的物质属于极性分子的是(写分子式),由分子组成的晶体中熔点较高的是(写分子式),由分子组成的晶体中密度较大的是(写分子式)
(3)反应物中有两种元素在元素周期表中位置相邻,请用一个化学方程式来表示它们的非金属性的大小,并请写出其中电负性较小的元素原子的价层电子排 布图:。
(4)制取冰晶石(Na3AlF6)的化学方程式中除氢外,其余原子的第一电离能由大到小的顺序
(5)冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,●位于大立方体顶点和面心 ,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是(填具体的微粒符号)。