工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 。
被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2 + 2C + 2Cl2═ TiCl4 + 2CO
(1)用双线桥法标出上述化学方程式的电子转移情况;
(2)指出该反应的氧化剂 ,氧化产物 ;
(3)当消耗标准状况下Cl2 11.2L时,则转移的电子数为 。
有X、Y、Z三种元素,X原子核内无中子,Y原子的核外有三层电子层,单质在常温常压下是黄绿色气体,Z原子在反应中容易失去一个电子形成稳定的结构 ,和氖具有相同的电子数。按要求回答下列问题:
(1)依次写出X、Z的元素符号: 、 ,画出Y原子结构示意图: 。
(2)元素X、Z形成的化合物与水反应有无色气体产生,反应后的溶液能使酚酞试液变红色,请写出该反应的化学方程式 。
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
① 0~6 min内,反应的平均速率v(Cl2)= ;
②下列说法不能判断该反应达到化学平衡状态的是 。(填字母)
| A.体系中Cl2的转化率不变 |
| B.体系中气体的平均摩尔质量不再改变 |
| C.每消耗1mol CO的同时生成1mol COCl2 |
| D.混合气体密度不变 |
③随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
④比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) T(15)
(填“<”、“>”或“=”)。
⑤若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡
移动(填“向正反应方向”、“向逆反应方向”或“不”);
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)如图所示,利用电化学原理将SO2转化为重要化工原料C
若A为SO2,B为O2,则负极的电极反应式为:________________________;
铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:
请回答下列问题:
(1)沉淀B的化学式为 ,溶液C中阴离子主要是 。
(2)操作Ⅰ是 (填操作名称)
(3)写出①过程中发生反应的离子方程式 。
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是 (填操作名称),简述洗涤沉淀的操作方法: 。
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有 (填化学式)。
(6)电解Al2O3制取金属Al的阳极电极反应式为 。
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。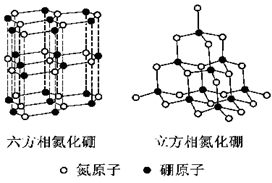
(1)基态硼原子的电子排布式为 。
(2) 关于这两种晶体的说法,正确的是 (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ,其结构与石墨相似却不导电,原因是 。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为 。该晶体的天然矿物在青藏高原在下约300km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有 mol配位键。