某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
25.05 |
25.00 |
23.80 |
24.95 |
则该醋酸溶液的浓度为________________。
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为 。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的 倍;
c (OH-) -c (CH3COOH) = mol·L-1。
下表是元素周期表的一部分。表中所列字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
 |
|||||||||||||||
试回答下列问题:
(1)请写出元素O的基态原子电子排布式。
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表(填元素符号);其中电负性最大的是(填图中的序号),第一电离能最大的是(填图中的序号)。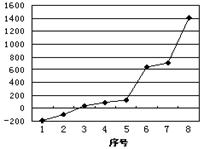
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是(填化学式),试从结构角度加以解释。
(4)COCl2俗称光气,分子中C原子采取杂化成键;分子中的共价键含有(填标号)
a.2个σ键b.2个π键c.1个σ键、2个π键d.3个σ键、1个π键
(16分)已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负 性仅小于氟。 性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有种不同运动状态的电子, 有种不同能级的电子。
有种不同能级的电子。
(2)X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号)。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)。
(4)R的核外电子排布式为。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是。
| A.[R(H2O)6]Cl3 | B.[R(H2O)5Cl]Cl2·H2O |
| C.[R(H2O)4Cl2]Cl·2H2O | D.[R(H2O)3Cl3]·3H2O |
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心原子为(写化学式),配位体为(写化学式),x 的值为。
(6) Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为。
X、Y、Z均为短周期元素,可形成X2Z和YZ2两种化合物。X、Y、Z的原子序数依次增大,X原子的K层的电子数目只有一个,Y位于X的下一周期,它的最外层电子数比K层多2个,而Z原子核外的最外层电子数比次外层电子数少2个。
(1)它们的元素符号分别为X;Y;Z;
(2) 用价层电子对互斥理论判断:
| 物质 |
价层电子对数 |
轨道杂化形式 |
分子的形状 |
分子的极性 |
| X2Z |
||||
| YZ2 |
已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2] 分子的空间构型是。若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A、B分子的几何构型:A,B。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: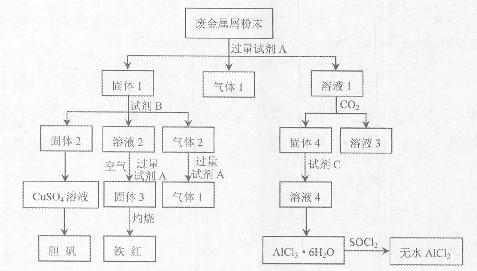
已知:①Al3+、Al(OH)3、AlO2-有如下转化关系: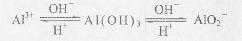
②碳酸不能溶解Al(OH)3。
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是。
(2)溶液2中含有的金属阳离子是;气体2的成分是。
(3)溶液2转化为固体3的反应的离子方程式是。
(4)固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4,并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是。