氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用。
(1)右图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g) 
其化学平衡常数K与温度t的关系如下表:
| t/℃ |
25 |
125 |
225 |
… |
| K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A. |
B. |
| C.容器内压强保持不变 | D.混合气体的密度保持不变 |
有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如下图所示。已知:A的碳链无支链,且A中只有一种官能团(-CHO);B为五元环酯。
已知:
(1)C中所含官能团是(写名称)
(2)B结构简式为
(3)写出下列反应方程式(有机物用结构简式表示)
G→ H
E→F(只写①条件下的反应)
(4)F的加聚产物的结构简式为
(10分) 自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构
和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
(1)上述系列中第1种物质的分子式为。
(2)以苯乙炔(CH≡C- )为基本原料合成芳炔类大环化合物是通过__________反应实现的(填反应类型)。
)为基本原料合成芳炔类大环化合物是通过__________反应实现的(填反应类型)。
(3)已知上述系列第1至第4种物质分别溶解于有机溶剂中,可形成胶体,则分散质的分子直径大约在之间,可通过现象证明所形成的分散系为胶体。
(4)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为。
根据下面的反应路线及所给信息填空。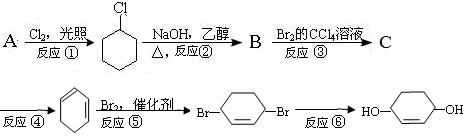


 (1)B的键线式,C的结构简式。
(1)B的键线式,C的结构简式。
(2)在①~⑥的各步反应中,属于取代反应的有,属于加成反应的有
(3)反应④所用的试剂和条件是。
(4)反应③的化学方程式是。
(5)反应④的化学方程式是。
(6)反应⑥的化学方程式是。
(6分)有机物A是合成药物(芬必得)的主要原料,其结构简式为 ,与A具有相同分子式,且苯环上只有一个取代基的有机物共有4种,除A以外还有的3种分别为:
,与A具有相同分子式,且苯环上只有一个取代基的有机物共有4种,除A以外还有的3种分别为:
(6分)按要求填空:
(1)羟基的电子式是
(2)苯酚钠溶液中通入CO2的化学方程式:
(3)苯乙烯与溴的四氯化碳溶液的反应方程式: