(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。
(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
则阴极的电极反应式为____________________________________________________。
⑴20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图⑴所示是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量(填“>”、“<”或“=”)CO2和NO的总能量。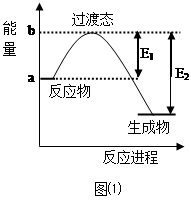
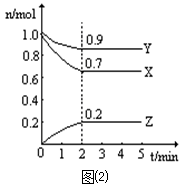
⑵某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质物质的量随时间的变化曲线如图⑵所示。根据图中数据,试填写下列空白:
①该反应在min时达到平衡状态(反应限度);
②该反应的化学方程式为:;
某烃A 0.2mol在氧气中恰好完全燃烧,生成化合物B、C各1.0mol,试回答:
(1)烃A的分子式是____ ____。
(2)若取一定量的烃A充分燃烧后,生成B、C各2mol,则完全燃烧时消耗标准状况下的氧气的体积为_____L。
(3)若烃A能使溴水褪色,则A可能的结构有种,写出其中一种的结构简式___ __。
(4)若烃A能使溴水褪色,写出其最简单的同系物发生加聚反应的化学方程式___________。
(5)烃A与氢气发生加成反应的产物中,一氯代物有四种的结构简式为____。
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为;
(2)乙元素在周期表中的位置为;
(3)丙元素的最高价氧化物的电子式为;
(4)甲与丁两种元素可组成的具有强氧化性的物质是。(填化学式)
下列各组物质(用序号填空):
① 金刚石和石墨;
②1H、2H、3H;
③ CH4和C10H22;
④乙烷和(CH3)2CHCH2CH3;
⑤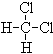 和
和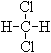 ;
;
⑥ CH3 (CH2) 3 CH3和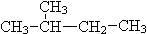
(1) 属于同一物质的是;
(2)互为同分异构体的是;
(3)互为同系物的是;
(4) 互为同素异形体的是;
(5) 互为同位素的是。
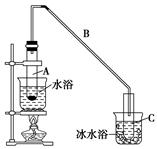
化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: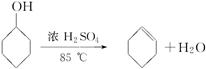
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液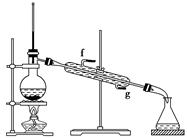
②再将环己烯按上图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,其目的是_____________________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点