将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
 CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)= mol-1·L-1·min-1。
②比较此时正、逆反应速率的大小:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是 。
.随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂可以水解成葡萄糖,再将葡萄糖转化为乙醇,用做燃料。
(1)写出绿色植物的秸秆转化为乙醇的化学方程式:
①____________________________________
②________________________________________。
(2)乙醇除用做燃料外,还可以用它合成其他有机物,以乙醇为起始原料的转化关系如图所示:(已知;在有催化剂的条件下,多步氧化R-CH2OH→R-CHO→RCOOH)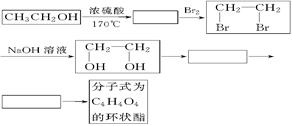
请在方框中填上相应物质的结构简式。
(3)写出上面转化关系图中由CH2OHCH2OH―→C4H4O4的化学方程式(有机物用结构简式表示)。
(9分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式______________________________________.
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式___________________.
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l ) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______________________.
.除去下列物质中含有的少量杂质,请填写应加入的试剂及操作方法:
| 组别 |
物质 |
杂质 |
试剂 |
操作方法 |
| A |
乙烷 |
乙烯 |
||
| B |
溴苯 |
溴 |
||
| C |
硝基苯 |
硝酸 |
||
| D |
CO2 |
HCl |
(10分)
苯佐卡因可用于粘膜溃疡、创面等的镇痛,是一种常用的局部麻醉剂,其合成路线如下图所示: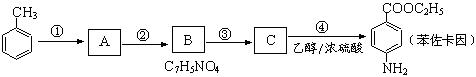
已 知:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
知:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。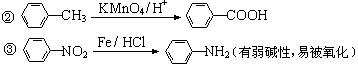
请回答下列问题:
(1)上述合成路线中属于取代反应的是 (填代号)。
化合物C 中含有的含氧官能团的名称为 。
中含有的含氧官能团的名称为 。
(2)合成路线中反应①的化学方程式为 。
(3)下列关于上述合成路线的说法中正确的是 。(填字母)
a.反应①除主要生成物质A外,还可能生成 、
、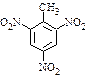 等
等
b.步骤①和②可以互换c.反应③是还原反应
(4)苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: 。
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。
(5)化合物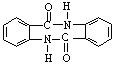 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
提示:① 合成过程中无机试剂任选;②合成路线流程图示例如下:
合成过程中无机试剂任选;②合成路线流程图示例如下: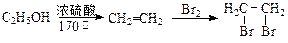
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)CH3+、·CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp3杂化,所有原子均共面 |
(2)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
①HCl、CS2、H2S、SO2四种分子中 μ=0的是;
μ=0的是;
②实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是构型,BCl3分子是构型。
(3) 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中 ,适合作录音带磁粉原料的是__________________。
,适合作录音带磁粉原料的是__________________。
(4)利用光电子能谱证实:在洁净铁(可用于合成氨
反应的催化剂)的表面上存在氮原子,右图为氮原子在
铁的晶面上的单层附着局部示意图(图中小黑色球代表
氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原
子数之比为________________。
(5)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积(填“A”或“B”)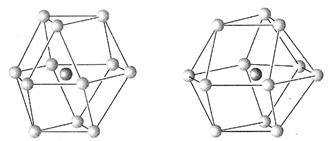
图A图B