一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
| 物质 |
AgCl |
AgI |
Ag2S |
| 颜色 |
白 |
黄 |
黑 |
| Ksp(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是( )
| A.溶度积小的沉淀可以转化为溶度积更小的沉淀 |
| B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
| C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
| D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
关于下图所示装置的说法中,不正确的是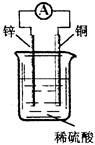
| A.铜片上发生氧化反应 |
| B.电子由锌片通过导线流向铜片 |
| C.该装置能将化学能转化为电能 |
| D.锌片是该装置的负极,该电极反应为Zn—2e-==Zn2+ |
下列物质中,既含离子键又含共价键的是
| A.NA2O | B.NH3 | C.NAOH | D.CABr2 |
下列表达方式错误的是
| A.H∶Cl | B.NA+ | C.188O | D.O=C=O |
对于某可逆反应的下列叙述中,不能说明反应一定达到平衡的是
| A.正反应速率与逆反应速率相等 | B.反应物的浓度与生成物的浓度不再改变 |
| C.在给定条件下反应达到最大限度 | D.反应物的浓度与生成物的浓度相等 |
下列互为同位素的是
| A.H2 D2 | B.14N 14C | C.16O 17O | D.金刚石 石墨 |