下列制取、检验、提纯或保存物质的方法可行的是( )
①向某溶液中加入KSCN溶液检验该溶液是否含有Fe3+
②用植物油、NaOH溶液制取肥皂
③向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体
④用焰色反应检验K+时须透过蓝色钴玻璃观察
⑤液溴用水液封后密封保存在棕色试剂瓶中
⑥向混有乙酸的乙酸乙酯中加入NaOH溶液再分液,提纯乙酸乙酯
| A.①③⑤⑥ | B.②④⑤⑥ |
| C.①②④⑤ | D.①③④⑥ |
化学是以实验为基础的自然科学,下列实验操作方法正确的是()
①制氧气用排水法收集氧气完毕后,应立即停止加热,以免浪费酒精
②给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④检查容量瓶是否漏水的方法是:向容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水
⑤为加速固体物质的溶解常采取搅拌、加热等措施
⑥使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水润湿后,再测量
⑦酒精灯在桌子上歪倒着火,立即用湿布盖上
⑧稀释浓硫酸时,将水沿器壁缓缓倒人浓硫酸中,并不断搅拌
| A.①③④⑥⑧ | B.①④⑤⑥⑦ | C.②③④⑤⑦ | D.②③⑤⑥⑧ |
设NA为阿伏伽德罗常数的数值,下列说法正确的是()
| A.7.8gNa2O2所含的阴离子数目为2NA |
| B.在熔融状态下,l mol KHSO4完全电离出的阳离子数目为2NA |
| C.14 g乙烯和丙烯的混和气体中共含有3NA对共用电子对 |
| D.将分子总数为NA的NH3和HC1的混合气体置于标准状况下,其体积为约22.4L |
含有三个键的炔烃,氢化后的结构简式为 ;此炔烃可能有的结构式以及该产物烷烃的一氯代物分别有
;此炔烃可能有的结构式以及该产物烷烃的一氯代物分别有
| A.3种、6种 | B.4种、7种 | C.2种、6种 | D.2种、8种 |
某烃的结构简式为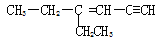 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数位c,则a、b、c分别为
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数位c,则a、b、c分别为
| A.4、3、5 | B.2、5、4 | C.4、3、6 | D.4、3、2 |
相对质量为100,主链上有五个碳原子的烃有
| A.5种 | B.4种 | C.6种 | D.3种 |