下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+= Cu2+ + 2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2 + H2O = 2Na+ + 2OH- + O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4- + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是()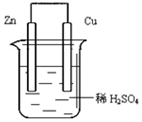
| A.铜片增重6.4g | B.锌片增重6.5 g |
| C.铜片上析出0.1 mol O2 | D.锌片溶解了6.5 g |
下列表述中正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ |
B.由C(石墨,s) C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,石墨比金刚石稳定 C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,石墨比金刚石稳定 |
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件的ΔH不同 2HCl(g)在光照和点燃条件的ΔH不同 |
| D.化学变化不一定都伴随着能量的变化 |
已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,
其能量变化如图所示,则Q的值正确的是()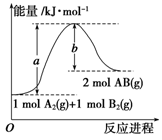
| A.a-b | B. a |
| C.-b | D. b-a |
用惰性电极分别电解下列各电解质的水溶液,一段时间后(设电解质足量),向电解后溶液中加入适量原电解质,可以使溶液恢复到电解前的浓度的是( )
A.Cu(NO3)2B.K2SO4C.HCl D.NaOH
MgAgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:
2AgCl+Mg === Mg2++2Ag +2Cl-。有关该电池的说法正确的是( )
| A.可用于海上照明供电 | B.负极反应为AgCl+e-===Ag+Cl- |
| C.Mg为电池的正极 | D.AgCl为阳极,发生了氧化反应 |