下列离子方程式书写正确的是 ( )
| A.碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH- |
| B.向氯化亚铁溶液中滴加新制氯水:Fe2++Cl2 |
| C.向次氯酸钠溶液中通人少量SO2:2ClO-+SO2+H2O |
| D.向FeCl3溶液中滴加过量NaOH溶液:Fe3++3OH-=Fe(OH)3↓ |
溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据右表可知,下列说法错误的是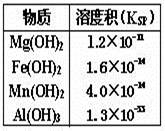
| A.Al3+最先转化为Al(OH)3沉淀 |
| B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀 |
| C.要使Mg2+转化为沉淀,溶液pH应大于9 |
| D.pH=14时,四种金属离子全部以沉淀形式存在 |
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
500 |
4600 |
6900 |
9500 |
| Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
下列元素电负性最大的是
| A.最高正化合价和最低负化合价的代数和为4的短周期元素 |
| B.最高正化合价与最低负化合价绝对值相等的元素 |
| C.没有负化合价的元素 |
| D.没有正化合价的元素 |
下列关于元素第一电离能的说法不正确的是
| A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大 |
| C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 |
| D.对于同一元素而言,原子的逐级电离能越来越大 |
若M是ⅡA族的某元素,则与M同周期且相邻的元素不可能位于元素周期表的
| A.ⅠA | B.ⅠB | C.ⅢA | D.ⅢB |