Ⅰ 在①苯 ②乙烯 ③甲苯 ④乙酸 ⑤乙醇中,(填编号)
(1)能和金属钠反应放出H2气的有
(2)能与NaOH溶液反应的有
(3)常温下能与溴水反应的有
(4)所有原子处于同一平面的是
(5)能使酸性KMnO4溶液褪色的有
Ⅱ 推断下列化合物的化学式:
⑹ X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是;若XY2是共价化合物,其化学式是_。
⑺ 1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该化合物的化学式为(写出两种)。
A、B、C三个烧杯中分别盛有物质的量浓度相同的足量稀硫酸。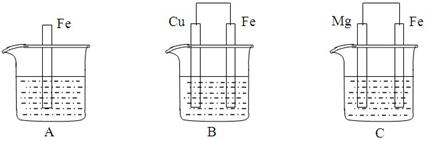
⑴A中反应的离子方程式为____________________________________________________
⑵B中Fe电极所发生反应的电极反应式为______________________________________,
Cu电极附近溶液的pH_____________(填“增大”、“减小”或“不变”)
⑶C中若正极产生112mL气体(标准状况),则负极金属质量减少_____________g。
⑷比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________________________(填字母)。
下图是元素周期表的一部分,请回答:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
||||
| 4 |
⑨ |
⑩ |
⑴元素⑦的原子结构示意图为______________;元素⑩的名称为______________。
⑵在这些元素中,化学性质最活泼的金属元素是___________(填元素符号,下同),最不活泼的元素是______________;原子半径最小的元素是______________。
⑶这些元素的最高价氧化物对应的水化物中,酸性最强的是______________(填化学式,下同);具有两性的是______________。
⑷写出元素④和⑤形成化合物的电子式______________,用电子式表示元素⑦和⑨所形成化合物的形成过程________________________________________________________。
有下列各组微粒或物质:
A.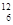 C和 C和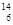 C C |
B.CH3CH2CH2CH3和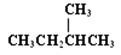 |
C.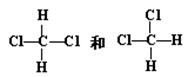 |
D.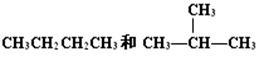 |
(1)__________组两种微粒互为同位素;
(2)__________组两种物质属于同系物;
(3)__________组两种物质互为同分异构体;
(4)__________组两种物质是同一物质。
完成以下实验:
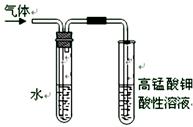
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题: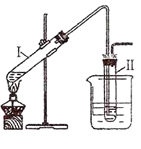
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式_。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有_、(写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有、_。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是_;下图中右边试管中的现象是;水的作用是。