用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.78 gNa2O2晶体中所含阴阳离子个数均为2NA |
| B.1.5 g CH3+中含有的电子数为NA |
| C.3.4 g氨气分子中含有0.6NA个N—H键 |
| D.常温下,100 mL1 mol·L-1AlCl3溶液中Al3+离子总数等于0.1NA |
NO和CO都是汽车尾气中的有害物质,它们能缓慢的起反应,生成N2和CO2,对此反应的下列叙述中正确的是()
| A.使用催化剂不能加快反应速率 | B.降低压强能加强反应速率 |
| C.升高温度能加快反应速率 | D.改变压强对化学反应速率无影响 |
已知4NH3+5O2====4NO+6H2O,则描述反应速率的关系正确的是()
A. v(NH3)=v(O2) v(NH3)=v(O2) |
B.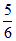 v(O2)=v(H2O) v(O2)=v(H2O) |
C. v(NH3)=v(H2O) v(NH3)=v(H2O) |
D. v(O2)=v(NO) v(O2)=v(NO) |
一个真空密闭容器中盛有1molPCl5,加热到200℃时发生了反应PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度下和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%,M与N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度下和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%,M与N的关系是( )
| A.M>N | B.M<N | C.M="N" | D.不能确定 |
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g),若经2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是( )
2C(g),若经2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是( )
①用物质A表示的反应的平均速率为0.3mol/(L·s)
②用物质B表示的反应平均速率为0.6mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7mol/L
| A.①③ | B.①④ | C.②③ | D.③④ |
影响化学反应速率的因素有多方面,如浓度、压强、温度、催化剂等。下列有关说法不正确的是()
| A.改变压强能改变气体反应的速率 |
| B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C.温度升高使化学反应速率加快的主要原因是增加反应体系中活化分子的百分数 |
| D.催化剂能加快化学反应速率主要原因是降低反应所需的能量 |