12.4g Na2R 含有Na+0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为 ,含R1.6g 的Na2R的物质的量为
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式;
(2)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=。
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下
反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为;x="" _________;
②若反应经2min达到平衡,平衡时C的浓度__0.8mol/L(填“大于”、“等于”或“小于”);
③改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,
起始加入的三种物质的物质的量a、b、c之间应满足的关系式
。
(2)若维持容器压强不变,改变起始物质加入的量,欲使反应达到平衡时C的物质
的量分数与原平衡相等,则起始应加入的A、B物质的量:____molA气体和2molB气体。
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下均用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是;反应过程中放出H2的速率依次为υa、υb、υc,则其关系是
根据下列有机化合物,回答问题。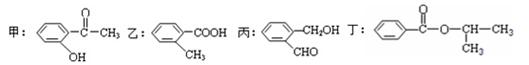
(1)上述互为同分异构体的化合物为;
(2)写出丙中官能团的名称;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。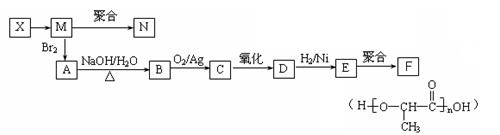
(ⅰ)X转化为M的反应类型是。写出N的结构简式:
(ⅱ)写出B转化为C的化学方程式;
(ⅲ)在一定条件下,E分子能脱去水形成多种化合物:
①请写出两分子E脱去一分子水的反应的化学方程式;
②在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为。
a、b、c、d、e、f、g是原子序数依次增大的前20号元素,其中只有g为金属元素,a是周期表中原子半径最小的元素,b的最外层电子数为电子层数的两倍,b、e ,d、f同主族,且d是地壳中含量最多的元素。试回答下列问题:
(1)a元素中没有中子的同位素的原子组成符号为,c与a按原子数目比为1∶3构成分子构型为;a与g的单质可按2∶1化合,试用电子式表示其形成过程。
(2)a与d形成的化合物中有一种称为“绿色氧化剂”。写出酸性条件下该化合物与FeSO4溶液反应的离子方程式:___________________________________。
(3)bf2的结构式为________________________,它是一种常见的溶剂,通常条件下1克该物质完全燃烧会释放出7.8 kJ的热,试写出该物质燃烧热的热化学方程式:
______________________________________________________________。
(4)标准状况下c的氢化物溶解度为700,用c的氢化物做喷泉实验后所形成的溶液密度为ρ g/cm3,该溶液的物质的量浓度C = ______________(此空用数据列出表达式即可)。
(5)已知单质A为常见黑色固体粉末,B是元素f的最高价含氧酸,其存在如图所示的转换关系: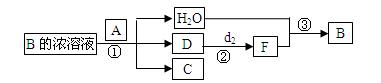
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解,因此反应①的条件 是;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 。
是;在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 。
(II) 若A是元素b的单质写出反应①的化学方程式:___________________