A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是( )
A. 原子序数:A>B B.A和B可能在同一主族
C. A可能在第2周期ⅣA族 D.A肯定是金属元素
下列实验操作不能达到预期目的的是
| 实验目的 |
操作 |
|
| A |
鉴别乙酸乙酯和乙酸 |
分别加入饱和碳酸钠溶液 |
| B |
比较水和乙醇中羟基氢的活泼性 |
分别加入少量金属钠 |
| C |
比较铁和铜的金属活动性 |
分别加入浓硝酸 |
| D |
比较碘在水和四氯化碳中的溶解度 |
向碘水中加入CCl4,振荡 |
用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( )
| A.3种 | B.4种 | C.5种 | D.6种 |
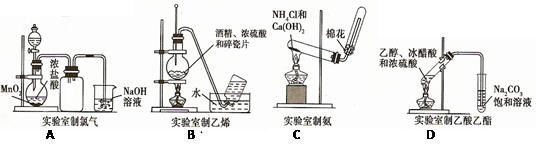
下列实验装置图正确的是
下列离子方程式正确的 是
是
| A.用氯气作为水的消毒剂:Cl2+H2O===2H++Cl-+ClO- |
| B.“胃舒平”里的氢氧化铝中和胃酸:Al(OH)3+3H+===Al3++3H2O |
| C.金属钠溶于足量水中:Na+2H2O=Na++H2↑+2OH- |
| D.过量铁屑溶于少量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示。下列
| 甲 |
乙 |
|
| 丙 |
丁 |
戊 |
判断正确的是
A.原子半径: 丙<丁<戊 B.金属性 :甲>丙
:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙