(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为 ;
乙同 学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质, 应选用的试剂是 。
应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32- (填“大”或“小”)外,还有
下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
⑴该浓盐酸中HCl的物质的量浓度为 mol·L-1。 ⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取 体积的多少而变化的是。
体积的多少而变化的是。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
⑶某学生欲用上述浓盐酸和蒸馏水配制500 ml 物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 ml 上述浓盐酸进行配制。 ②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、用量筒量取浓盐酸时仰视观察凹液面()
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水()
③该36.5%的浓盐酸,若加入等质量的水稀释后,质量分数18.25%;若加入等体积的水稀释后,质量分数18.25%(用“小于”或“等于”或“大于”来填空)
掌握仪器的名称、组装及使用方法是中学化学实验的基础,右下图为两套实验装置。

⑴写出下列仪器的名称:
①;②;④;
⑵仪器①~④中,使用时必须检查是否漏水的有。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有;将仪器补充完整后进行的实验操作的名称为:。现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是。
欲除去硝酸钾固体中混有的少量氯化钾杂质,某学生进行如下实验操作。回答下列问题:
⑴溶解样品。该过程所需的仪器有。
⑵向溶解后的溶液中加入适量的溶液,使氯化钾转化为沉淀。(填化学式)
⑶将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误: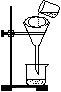
①;
②。
(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用ml量筒,实验中还需要用到的仪器有,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________mol/L, Na2SO4的物质的量浓度是___________mol/L。
(14分)某同学帮助水质检测站配制960mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的________(填选项字母)之间。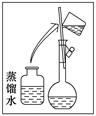
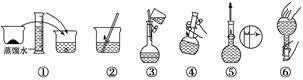
A.②与③ B.①与② C.④与⑤
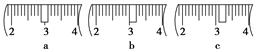
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
| a |
b |
c |
d |
e |
|
| 砝码大小/g |
100 |
50 |
20 |
10 |
5 |
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会__________(填“偏大”“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会____________。