德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如右图)。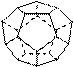
请回答: C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)ΔH2
CH3OH(g) + H2O(g)ΔH2
① 上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)
ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g)= H2O(l)ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol CO和液态水放出的热量为
(3)利用甲醇燃料电池设计如右图所示的装置: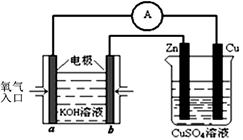
则该装置中Cu极为极;
写出b极的电极反应式。
(一)含铜物质是化学中的重要试剂。例如利用新制氢氧化铜悬浊液验证葡萄糖的还原性。
新制氢氧化铜悬浊液的配制与应用:
(1)实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的________溶液2mL,滴入2%的_________溶液4~6滴(以上选填“硫酸铜”或“氢氧化钠”),振荡即成。这样操作的目的_______________________________________________。
(2)下列各组物质的溶液仅用新制的氢氧化铜悬浊液(必要时可以加热)不能检验出来的是______。
| A.HCOOCH3,C6H5COOH,C6H5CH2OH |
| B.NaHSO4,BaCl2,Na2CO3,酚酞 |
| C.HCOOH,HCOONa,HCOOCH2CH3 |
| D.葡萄糖,CH2OHCHOHCH2OH |
(二)下图是某同学在实验室中制取Cl2的装置图: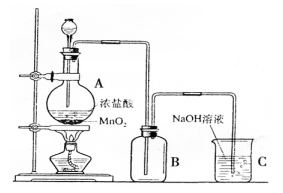
(1)该装置中的错误之处有二,分别是:
①
②
(2)试写出装置A和C中发生反应的离子方程式:
A处:;C处:。
Ⅰ(10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子。B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。回答下列问题:
(1)写出相应元素符号,ABCE
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴人紫色石蕊试液溶液呈红色,则溶液中离子浓度由大到小的排列顺序为:。
(3)将铝片和镁片插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为。
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
试回答下列问题
(1)G的化学式为:
(2)写出下列反应的化学方程式
①
②
(1)某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
①若X=1,容器体积保持不变,新平衡下E的体积分数为________.
②若X=2,容器体积保持不变,新平衡下F的平衡浓度____0.5a mol/L。
(2)t℃将3mol A气体和1mol B气体通入2L固定体积的密闭容器中,发生如下反应:3A(g) + B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
①从开始反应至达到平衡状态,生成C的平均反应速率为_________,X=_____.
②若继续向原平衡混合物中通入少量氦气(不参与反应)后,化学平衡将____移动。
③若向原平衡混合物的容器中再充入a molC,在t℃达到新的平衡,此时B的物质的量为n(B)=_____________mol。
④如果上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)n(B) n(C)之间应该满足的关系为_____________________.
根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。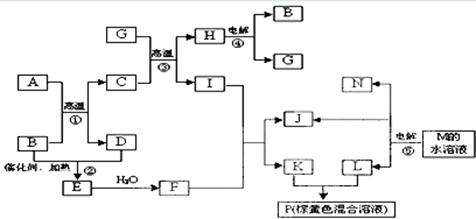
(1)I元素在元素周期表中的位置;M中阴离子的结构示意图:。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为。
(3)写出下列化学反应的离子方程式:
①溶液P与KSCN溶液:________________________________________;
②G与N的反应:______________________________________ ____ ______;
______;
③K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为: