12.4 g Na2X中含Na+ 0.4 mol,则Na2X的摩尔质量是____________________,X的相对原子质量是_______________。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为mol·L-1·s-1反应的平衡常数K1=。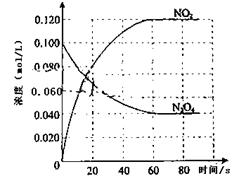
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是。
②温度T时反应的平衡常数K2 =
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断的理由是:。
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:。
(8分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 |
|||
| T1 |
t2 |
ΔH |
|||
| ① |
50 mL0.55 mol·L-1 NaOH溶液 |
50 mL0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.3 ℃ |
|
| ② |
50 mL0.55 mol·L-1 NaOH溶液 |
50 mL0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.5 ℃ |
(已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。)
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
(4)若用KOH代替NaOH,对测定结果(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。
(10分)下图是工业生产硝酸铵的流程。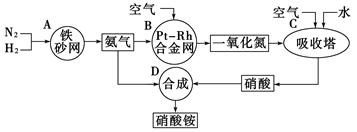
(1)吸收塔C中通入空气的目的是__________________ 。A、B、C、D四个容器中的反应,属于氧化还原反应的是________(填字母)。
(2)已知:4NH3(g)+3O2(g)===2N2(g) +6H2O(g)ΔH=-1266.8 kJ/mol
N2(g)+O2(g)===2NO(g)ΔH=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:____________________________。
(3)已知:N2(g) +3H2(g)  2NH3(g) ΔH=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有______________(填字母)。
2NH3(g) ΔH=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有______________(填字母)。
A.升高温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3 : 1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,求此时H2的转化率?(要有完整的计算过程,结果保留三位有效数字)
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
(1)写出实验流程中下列物质的化学式: 试剂X :,沉淀A:,沉淀B:。
(2)上述实验流程中加入过量的Na2CO3的目的是。
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是 _________(填操作名称)。
某双原子分子构成的气体,其摩尔质量为Mg/mol,该气体质量为mg,阿伏加德罗常数为NA,则:
(1) 该气体的物质的量为mol
(2) 该气体的一个分子的质量为g
(3) 该气体在标准状况下的密度为g/L
(4) 该气体所含原子总数为个