(10分)下图是工业生产硝酸铵的流程。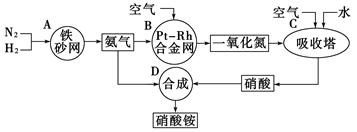
(1)吸收塔C中通入空气的目的是__________________ 。A、B、C、D四个容器中的反应,属于氧化还原反应的是________(填字母)。
(2)已知:4NH3(g)+3O2(g)===2N2(g) +6H2O(g)ΔH=-1266.8 kJ/mol
N2(g)+O2(g)===2NO(g)ΔH=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:____________________________。
(3)已知:N2(g) +3H2(g)  2NH3(g) ΔH=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有______________(填字母)。
2NH3(g) ΔH=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有______________(填字母)。
A.升高温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3 : 1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,求此时H2的转化率?(要有完整的计算过程,结果保留三位有效数字)
下列反应中,属于放热反应的是,属于吸热反应的是(填序号)。
①煅烧石灰石(主要成分CACO3)制取生石灰(CAO) ②燃烧木炭取暖 ③炸药爆炸④酸与碱中和反应 ⑤食物因氧化而腐败 ⑥生石灰与水作用制熟石灰⑦BA(OH)2·8H2O晶体与NH4Cl晶体⑧金属钠与水的反应
下表是元素周期表的一部分,回答下列有关问题: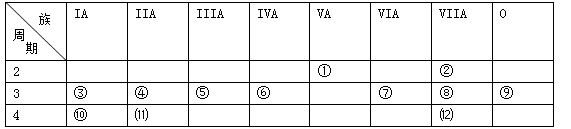
(1)写出下列元素符号:①,⑥,⑦。
(2)在①-⑿元素中,金属性最强的元素是,非金属性最强的元素是,最不活泼的元素是。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
| A.常温下⑦的单质和⑧的单质状态不同 |
| B.⑧的氢化物比⑦的氢化物稳定 |
| C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应 |
| D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强 |
(共8分)
(1)标准状况下,1.68L无色可燃气体在足量氧气中完全燃烧,若将产物通入足量澄清石灰水,得到的白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g.
①燃烧产物中水的质量为_________ g
②若原气体是单一气体,它的分子式为____________
(2)在100℃时,某有机物蒸汽20ml与60ml氧气混合,点燃后恰好完全反应,生成CO2与水蒸气体积为1:1.5 若将混合气体通过盛浓硫酸的洗气瓶后,气体变为40ml。有机物的分子式为___________
写出下列反应的化学方程式:(共12分每空2分)
(1)乙烯使溴水褪色的反应,反应类型
(2)苯→硝基苯,反应类型
(3)在碱性条件下乙醛与新制的Cu(OH)2反应,反应类型
(共14分 )
(1)甲烷的结构式是。乙烯的电子式是。将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是______。
(2)在烷烃分子中,每增加一个碳原子,1mol烷烃完全燃烧需要多消耗氧气(填字母)________。
A.1molB.1.5mol C.2mol D.2.5mol
(3)乙醇分子内有四种不同的化学键(如图) ,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键。
,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键。
A.乙醇在热的铜丝催化下发生氧化反应:,断裂(填序号)化学键;
B.乙醇中投入钠粒冒气泡:,断裂(填序号)化学键。