实验室常用的几种气体发生装置如图A、B、C所示: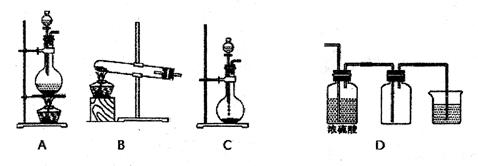
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。检查C装置气密性是否良好的操作方法是
。
若用B装置制取氨气,用化学方程式表示制取氨气的反应原理 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是 ,用离子方程式表示制取氯气的反应原理 。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是 。发生反应的离子方程式为 。
(4)下图是某同学设计收集氨气的几种装置,其中可行的是 
(15分)海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: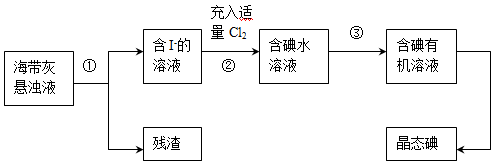
(1)灼烧海带时需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A 烧杯 B 蒸发皿 C.坩埚 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出上图中提取碘的过程中有关的实验操作名称:①,③。
(3)操作③中所用的有机试剂可以是(只填一种),简述选择其理由。
(4)操作过程③可以分解为如下几步:
把盛有溶液的分液漏斗放在铁架台的铁圈中;
把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
检验分液漏斗活塞和上口的玻璃塞是否漏液;
倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
旋开活塞,用烧杯接收溶液;
从分液漏斗上口倒出上层液体;
将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母);
(b)上述G步操作的目的是:;
(c)最后碘的有机溶液是通过获得(填“漏斗上口”或“漏斗下口”)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
(6)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察下图所示实验装置指出其错误之处。
进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A 100mL量筒 B托盘天平 C玻璃棒 D 50mL容量瓶
E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是。
(2)本实验需量取浓硫酸的体积为mL,量取时应选择的仪器是(填上述字母)。
(3)在容量瓶使用方法中,下列操作不正确的是(填字母)。
| A.使用容量瓶前检查它是否漏水 |
| B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| C.将确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
(4)下列情况使所配制的稀硫酸浓度偏大是 (填序号)
①所用的浓硫酸长时间放置在密封不好的容器中
②容量瓶用蒸馏洗涤后残留有少量的水
③定容时俯视溶液的凹液面
某同学用某种粗盐进行提纯实验,步骤见下图.
请回答:
(1) 步骤①和②的操作名称是________.
(2) 步骤③判断加入盐酸“适量”的方法是_____________________________;
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________________,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含 CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
猜想Ⅰ成立 |
|
| 猜想Ⅱ:固体A中含 BaCO3 |
取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
|
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水,________ |
猜想Ⅲ成立 |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

I II
⑴ 写出下列仪器的名称:
a. b. c.
⑵ 仪器a~e中,使用前必须检查是否漏水的有。(填序号)
⑶ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由(填f或g)口通入,口流出。
(4) 现需配制0.125mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
① 图中的错误是。除了图中给出的仪器和分析天平外,为完成实验还需要的仪器有:。
②根据计算得知,需称量NaOH的质量为g。称量时,往左盘烧杯中逐步添加药品至天平平衡,当只缺少量晶体时,其操作方法是_____________________________
② 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④ 下列操作使配制的NaOH溶液浓度偏低的有________.
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
某同学设计了如下实验探究盐的水解反应规律。
(1)向碳酸钠溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:
(2)用pH试纸测得硫酸铝溶液的pH为3,用离子方程式表示硫酸铝溶液呈酸性的原因: ;
简述测定该溶液的pH的操作方法是:
(3)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式: