掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

I II
⑴ 写出下列仪器的名称:
a. b. c.
⑵ 仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
⑶ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 (填f或g)口通入, 口流出。
(4) 现需配制0.125mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
① 图中的错误是 。除了图中给出的仪器和分析天平外,为完成实验还需要的仪器有: 。
②根据计算得知,需称量NaOH的质量为 g。称量时,往左盘烧杯中逐步添加药品至天平平衡,当只缺少量晶体时,其操作方法是_____________________________
② 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④ 下列操作使配制的NaOH溶液浓度偏低的有________.
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
已知A是灰黑色的硬而脆的固体,B是气态物质,A~E各种物质的相互转化关系如下图所示。
(1)写出B、D、E三种物质的化学式: B ,D ,E ;
B ,D ,E ;
(2)画出A的原子结构示意图 ;
(3)写出C→A的化学方程式 。
除去下列溶液的少量杂质,根据要求填空。
| 物质 |
杂质 |
选用试剂 |
离子方程式 |
| NaNO3 |
NaCl |
||
| KCl |
K2CO3 |
||
| NaHCO3 |
Na2CO3 |
将过量的SO2分别通入下列溶液:①氢硫酸②溴水③品红溶液④澄清石灰水⑤酸性高锰酸钾⑥氯化钙溶液,根据要求填空。
(1)无明显现象的是;
(2 )溶液颜色褪去的是;
)溶液颜色褪去的是;
(3)SO2作氧化剂的是;
(4)SO2作还原剂的是;
(5)先生成沉淀然后沉淀溶解的是;
(6)有沉淀生成且沉淀不溶解的是。
碳族元素位于周期表中的族,在碳族元素中,单质能作半导体材料的元素是(填元素符号,下同),+2价化合物稳定的元素是 ,形成的气态氢化物最稳定的元素是。
,形成的气态氢化物最稳定的元素是。
Ⅰ.实验室制备硝基苯主要步骤如下:①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。③在50℃至60℃下发生反应,直至反应结束。④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤。⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写以下空白:
(1)配制一定比例浓硫酸和浓硝酸混合酸时,操作注意事项:___________________;
(2)操作③中,为了使反应在50℃至60℃下进行,常用的方法是:________________;
(3)步骤④中,分离粗硝基苯应使用的仪器是:________________________;
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是:___________________;
Ⅱ.某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水。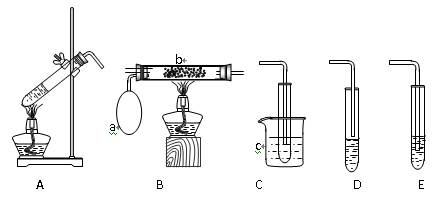
(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是(填序号),该装置中应加入试剂。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是。
(2)若用A装置做乙醇氧化成乙醛的实验,则还应选用的装置是填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是(填序号)。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1mL2%的AgNO3溶液