下列实验操作与相对应实验目的正确的是
| |
实验操作 |
实验目的 |
| A |
C2H4与SO2混合气体通过盛有溴水的洗气瓶 |
除去C2H4中的SO2 |
| B |
制乙炔时用饱和食盐水代替水 |
减慢化学反应速率 |
| C |
淀粉溶液水解后冷却至室温,加碘水观察现象 |
检验淀粉是否完全水解 |
| D |
将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 |
检验溴乙烷中的溴原子 |
已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是
| A.X的能量一定低于M的能量,Y的能量一定低于N的能量 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
已知可逆反应X(g)+Y(g)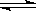 Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
| A.发生反应时,各物质的反应速率大小关系为:v(X)=" v(Y)=" 2v(Z) |
| B.图a中反应达到平衡时,Y的转化率为37.5% |
| C.T0℃时,该反应的平衡常数为33.3 |
| D.该反应正反应的反应热△H<0 |
右图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示。
依据图示,推出盐酸和NaOH的物质的量浓度是
| 物质的量浓度(mol/L) |
A |
B |
C |
D |
| c(HCl) |
0.12 |
0.04 |
0.03 |
0.09 |
| c(NaOH) |
0.04 |
0.12 |
0.09 |
0.03 |
关于下列各装置图的叙述中,不正确的是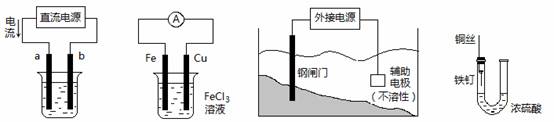 ① ② ③ ④
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;
④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
| A.由水电离的c(H+):①=②>③=④ |
| B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |