已知某化学反应的平衡常数表达式为K=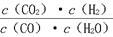 ,在不同的温度下该反应的平衡常数如下表:下列有关叙述不正确的是 ( )
,在不同的温度下该反应的平衡常数如下表:下列有关叙述不正确的是 ( )
| t ℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min 后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式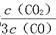 =
=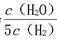 ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是()
| 物质及其杂质 |
检验 |
除杂 |
| A.Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |
| C.CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D. NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |
下列说法正确的是()
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
实验是研究化学的基础,下列图中所示的实验方法、装置或操作中正确的是() 
| A.制取Fe(OH)2 | B.测定中和热 |
| C.测定反应速率 | D.分离乙醇和乙酸的混合液 |
分类是化学学习与研究的常用方法,下列分类正确的是()
| A.Na2O、MgO、Al2O3均属于碱性氧化物 |
| B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.石灰石、生石灰、熟石灰均属于碱 |
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g) C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
A. 在上述反应体系中加入催化剂,化学反应速率增大,E 和E
和E 均减小
均减小
B. 该温度下,反应的平衡常数数值约为7.36;若升高温度,该反应的平衡常数减小
C. 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行
D. 反应在第4秒钟达到化学平衡状态,此时以A表示的速率是v(A)=0.225mol·L ·s
·s