下列离子方程式书写正确的是
| A.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+ |
| B.实验室吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| C.NH4HCO3溶液与过量的NaOH溶液反应:NH4++OH-=NH3↑+H2O |
| D.铜片溶于稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
下列事实与氢键有关的是
| A.水结成冰体积膨胀 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
关于硫原子核外电子的叙述错误的是
| A.排布在K、L、M三个电子层上 | B.3p能级上有2个空轨道 |
| C.共有16种不同的运动状态 | D.共有5种不同的能级 |
金属的下列性质和金属晶体结构无关的是
| A.良好的导电性 | B.良好的延展性 | C.反应中易失电子 | D.良好的导热性 |
铋(Bi)在医药方面有重要应用。下列关于 Bi和
Bi和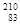 Bi的说法正确的是
Bi的说法正确的是
A. Bi和 Bi和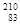 Bi都含有83个中子 Bi都含有83个中子 |
B. Bi和 Bi和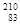 Bi互为同位素 Bi互为同位素 |
C. Bi和 Bi和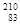 Bi的核外电子数不同 Bi的核外电子数不同 |
D. Bi和 Bi和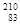 Bi分别含有126和127个质子 Bi分别含有126和127个质子 |
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
| A.He: | B.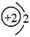 |
C.1s2 | D.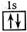 |