(11分) 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实 验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— =" " AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因: 。
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程 :
: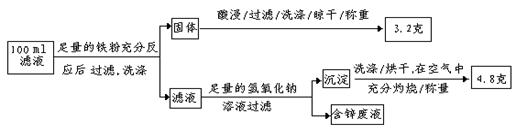
则100mL滤液中Cu2+的浓度为 mol·L—1,Fe2+的浓度为 mol·L—1
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: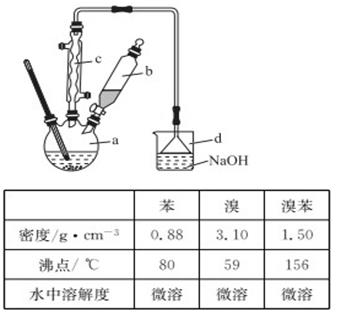
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体,继续滴加液溴滴完。装置d的作用是______________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________;
③向分出的粗苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A.25 mL B.50 mLC.250 mLD.500 mL
如下图所示,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是_______________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是______________。
(3)若A、B两个洗气瓶的质量都增加,则气体X可能是(可以不填满)
| ① |
② |
③ |
④ |
⑤ |
实验室用图示装置制取乙酸乙酯。
(1)浓H2SO4的作用是:①_____ _ __,②_____________。
(2)右边收集试管内装有,该溶液的作用是____________________。导气管不能插入液面以下,原因是。加热前,大试管中加入几粒碎瓷片的作用是______________。
(3)制取乙酸乙酯的反应方程式是_______________________________________。
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_________________。
Ⅰ、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为。
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点,(填“同意”或“不同意”),说明理由(用离子方程式表示)。
Ⅱ、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
回答下列问题:
(4)配平在滤液(Ⅲ)中发生反应的化学方程式:NOx+H2O+O2=HNO3
(5)写出制取硫酸铜的总反应方程式:。
(6)在上述生产过程中,被循环使用的物质是。
(10分)为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 |
电极材料 |
电解质溶液 |
电子流向 |
| ① |
Mg—Al |
HNO3(浓) |
Mg→Al |
| ② |
Mg—Al |
HCl(aq) |
Mg→Al |
| ③ |
Mg—Al |
NaOH(aq) |
Al→Mg |
| ④ |
Al—Cu |
HNO3(浓) |
Cu→Al |
根据以上表格内容回答:
(1)(4分)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作________,总反应:__________(同上)
(2)(6分)实验2中Mg电极反应式为__________________。
Al电极上的电极反应式为______________________,总的电池反应是_______________________。