(14分).酸碱中和滴定是中学化学常见实验。
Ⅰ右图表示50mL酸式滴定管中液面的位置,如果 液面处的读数是a,则滴定管中剩余液体的体积是______mL
液面处的读数是a,则滴定管中剩余液体的体积是______mL
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ 某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用 各待盛溶液润洗。
各待盛溶液润洗。
D.将物质的量浓度为1.50mol·L-1标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
| V1 |
V2 |
||
 ① ① |
20.00 |
0.50 |
22.60 |
| ② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
(15分)工业上常用铁质容器盛装冷浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol·L-1酸性KMnO4溶液、0.10mol·L-1 KI溶液、新制氯水、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有 气体。
【实验探究】
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol·L-1酸性 KMnO4溶液,滴入所得溶液中 |
|
|
| 步骤②: |
|
含有Fe3+ |
|
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种或 以上气体 |

【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行,并说明原因: 。
(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如下图(图中夹持仪器省略)。
①Q产生的原因是 (用化学方程式表示)。
②为确认Q的存在,则M中盛放的试剂为 ,并将装置M添加于 (选填序号)。
a.A之前b.A-B间c.B-C间d.C-D间
③装置图中D、E、F组合的作用是 。
某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析小组成员从理论上分析,认为下列分解产物不可能的是 。
a.Fe2O3、SO3、H2O
b.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为 。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热双通管。
③观察到A中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 。
结论2:C中溶液褪色,可推知产物中有 。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液
c.H2O2 d.NaOH溶液
【化学选修——有机基础化学】阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸) 与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林的化学方程式 。阿司匹林的含氧官能团的名称是___________,反应类型是_________。
(2)①合成阿斯匹林时,加饱和NaHCO3的作用是 。
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)检验产品中是否含有水杨酸的试剂和方法是 。
(4)该学习小组在实验中原料用量:4.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=4.6g,则所得乙酰水杨酸的产率为 。
(15)硫代硫酸钠(Na2S2O3)可用作照相业的定影剂、电镀业的还原剂、净水工程的净水剂。某校化学研究性学习小组欲通过制取硫代硫酸钠,并通过实验探究硫代硫酸钠的化学性质。
(1)实验室制取硫代硫酸钠的反应原理可表示为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2。该研究性学习小组利用如图所示装置制取Na2S2O3,其中NaOH溶液的作用是___________________;如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有________________(填化学式)杂质生成。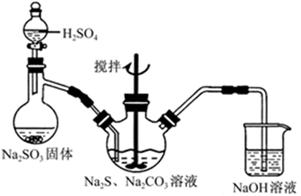
(2)用pH试纸检测硫代硫酸钠溶液的pH,正确的操作是_________________,测得溶液pH=8,根据盐溶液呈酸碱性的原理,用离子方程式解释可能的原因:____________________________;
(3)已知:S2O32-+2H+=S↓+SO2↑+H2O,市售硫代硫酸钠试剂中常含有硫酸根杂质,设计一个实验检验之。请完成下表:
| 实验步骤 |
预期现象 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
|
| 步骤2: |
|
| 步骤3: |
(4)Ba2+是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol/L Na2S2O3进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL。部分反应的离子方程式为:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32--=2I-+S4O62-。
①以淀粉为指示剂,则达到滴定终点的现象是_________________;
②该废水中Ba2+的物质的量浓度为_______________________。
肉桂酸用途广泛,常被用作食品保鲜剂、食品添加剂、有机合成中间体等。其一种合成原理如下:
【实验步骤】
①向A中依次加入沸石、一定比例的苯甲醛、乙酸酐及少许碳酸钾。
②控制温度1500C~1700C,使其充分反应。
③向冷却后的三口瓶内加入饱和碳酸钠溶液,调节pH至9~10。
④如装置B所示,用水蒸气蒸馏,除去未反应的苯甲醛。
⑤加入活性炭,充分振荡并煮沸脱色。
⑥……
(1)装置A中冷凝管由 端(填“a”或“b”)通入冷凝水。
(2)步骤③中加入饱和碳酸钠溶液将肉桂酸、醋酸转化为肉桂酸钠和醋酸钠的原因: 。
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为 ,玻璃管的作用为 。
(4)当观察到冷凝管中 ,说明水蒸气蒸馏结束。
(5)步骤⑥通过以下操作分离、提纯得较纯净的肉桂酸(难溶于水),其正确的操作顺序是 (填字母)。
a.重结晶 b.冷却、抽滤,水洗晶体
c.加入浓盐酸调节pH=3d.静置,趁热过滤得肉桂酸钠溶液