重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ。取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr2O72-在酸性条件下具有强氧化性,易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为 .
(2)步骤Ⅱ中的滴定过程,滴定终点的现象为 ;选用 (填“酸式”或“碱式”)滴定管。
(3)已知:MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为 。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数 ;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出 。
(5)[实验探究]有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是 (填“偏高”、“偏低”或“无影响”)。
请设计一个简单实验检验FeSO4溶液是否变质 。
(本题16分)焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:。
(2)“灼烧”时发生反应的化学方程式:。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:。
(4)副产品X的化学式是:;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为。
(6)检验产品中含有碳酸钠杂质所需试剂是(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸
(本题共16分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: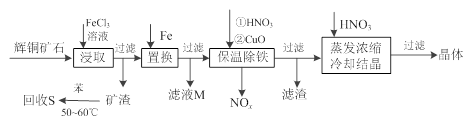
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
4.7 |
2.7 |
7.6 |
| 完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)写出浸取过程中Cu2S溶解成Cu2+的离子方程式 _________________________。
(2)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为 _______________________________________________________
(3)可向滤液M中加入(或通入)下列 ____(填字母)物质,得到较多的另一种可循环利用的物质。
A.Fe B.NaClO C.H2O2 D. Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是 _______________________。
(5)在除铁阶段,如果pH控制不当会使产量降低。你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为________,充分反应后过滤,将滤液与原滤液合并。
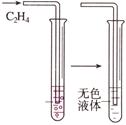
右图是实验室制乙烯的发生装置和乙烯性质实验,根据图示回答下列问题: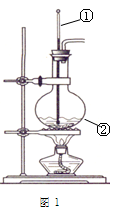
 (图2)
(图2)
(1)图1中仪器①、②的名称分别为_______、________。
(2)写出②中发生反应的化学方程式:。
(3)反应前在②中放入几块碎瓷片的目的是。
(4)向溴的四氯化碳溶液中通入乙烯(如图2),溴的橙红色很快褪去,该反应属于________(填反应类型),反应的化学方程式为____________________________。
(5)请给下面的有机物命名。
CH3CH2C(CH3)2C(CH2CH3)2CH3
Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式:。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
请回答:
(1)图中各装置接口连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略,):→→→⑥ → ⑦ →→→
(2)装置C中放入的反应物是和(填化学式)。
(3)装置B的作用是。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意__a___和(填字母编号)。
| A.视线与凹液面最低处相平 | B.等待气体恢复常温才读数 |
| C.读数时应上下移动乙管,使甲乙两管液面相平 | D.读数时不一定使甲乙两管液面相平 |
(5)实验测得收集的氧气在标准状况下体积为V L,则参与反应的Na2O2的物质的量为mol。
实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液250 mL:
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A.计算 B.称量 C. D. E.F.定容 G.摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有______ __
使用容量瓶前必须进行的一步操作是________.
(3)需称量________g烧碱固体,固体应该放在________中称量。
(4)定容时的操作应为用玻璃棒引流加入蒸馏水,至液面离刻度线约__________,改用______ _滴加至凹液面下沿与刻度线相平。
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________.(双选)
A.没有洗涤烧杯和玻璃棒 B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶不干燥,含有少量蒸馏水 D.定容时俯视刻度线
E.未冷却到室温就将溶液转移到容量瓶并定容
(6)若从所配制溶液取出100 mL ,则这100 mL溶液的物质的量浓度为__________________,
若再将这100 mL溶液加水稀释成1 L的溶液,则稀释后所得溶液的物质的量浓度为____________________。