13分)A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
⑴若A是淡黄色化合物;D是CO2;C为NaOH。
①写出A的电子式
②写出反应Ⅱ的化学方程式
⑵若A是地壳中含量最多的金属元素的单质,B在火焰上灼烧时火焰呈黄色,E是一种无色无味的气体,遇澄清的石灰水变浑浊。
①写出B的化学式 ②写出反应Ⅲ的离子方程式
③用单线桥法表示反应Ⅰ电子转移的方向和数目 。
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、0四种元素的电负性由小到大的顺序为_____________________。
②下列叙述不正确的是_____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
B.HCHO和CO2分子中的中心原子均采用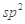 杂化
杂化
C.C6H6分子中含有6个 键和1个大
键和1个大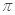 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是__________。
②六氰合亚铁离子[Fe(CN)6]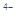 中不存在______________________________________。
中不存在______________________________________。
A.共价键 B.非极性键 C.配位键 D. 键 E.
键 E.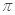 键
键
写出一种与CN-互为等电子体粒子的分子式_____________________。
(3) SO3分子的立体构型为_____________,SeO32-的立体构型为_______________。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是,GaAs中Ga的化合价为。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为;
AsH3的沸点高于PH3,其主要原因为。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为,与其互为等电子体的分子的化学式为(任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。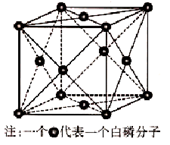
目前,我省多地正在积极推广使用太阳能。常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为______。
(2)砷、碲是第四周期的相邻元素,已知砷的第一电离能(947kj • mol-1)大于碲 (941 kj • mol-1)。请从原子结构的角度加以解释_________。
(3)As2O3俗名砒霜,是一种剧毒物质。法医检验砒霜中毒的方法是:向试样中加入锌 粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”。请用化学方程式表示检验原理:
__________________、__________________
(4)硼酸(H3BO3)在水溶液中易结合一个OH—生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________。
②[B(OH)4]-的结构式为____________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体 硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂)。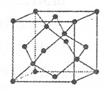
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______ (用化学式表示
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有______个氮原子、______个硼原子,立方氮化硼的密度是______g • cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(2014届北京市东城区高三下学期零模诊断理综化学试卷)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下: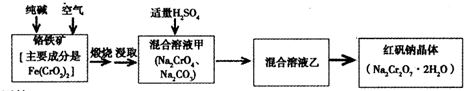
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下: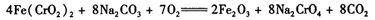
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:
①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。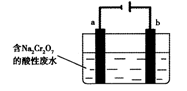
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
(2014届浙江省温州市高三第一次适应性测试理综化学试卷)
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下: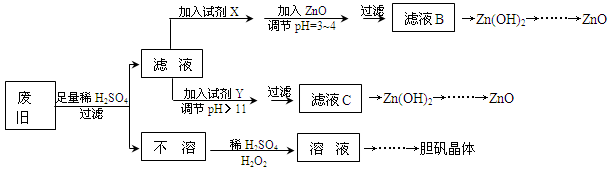
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ |
Fe2+ |
Zn2+ |
|
| 开始沉淀的pH |
1.1 |
5.8 |
5.9 |
| 沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-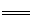 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32-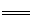 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。