(7分)某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液。实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与。
【提出问题】废液中含有什么物质?
【交流表达】(1)小明通过观察,认为废液中一定含有硫酸铜。他观察到的现象是_____。
(2)小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是______________________。
【作出猜想】小华认为废液中还可能含有硫酸。
【实验验证】(1)小华测得废液的pH小于7,证明废液中含有硫酸。用pH试纸测定溶液pH的方法是________________________________________________________________。
(2)小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论。小明的实验现象是_______________________________。通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸。
【拓展应用】
(1)若将废液中的溶质全部转化为硫酸亚铁,应向废液中加入过量的______________。写出该反应过程中的一个化学方程式______________________________________________。
(2)反应完全后,过滤,滤渣中物质为________________,滤液中溶质为硫酸亚铁。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,主要成分是一氧化碳、氢气及少量的二氧化碳和水蒸气.某课题组同学为验证水煤气的成分,做了以下准备:
(一)资料收集:①
②
.
③无水硫酸铜遇水由白色变为蓝色
(二)设计实验装置
请分析上面信息后回答:
①你认为验证水煤气中各成分的顺序依次是;
②装置C的目的是,装置D的作用是;
③装置E内观察到的现象是;
④实验中两次用到装置A,其目的分别是,;
请你设计一种尾气处理方案:.
(2)(4分)不少家庭养观赏鱼,有时会在鱼缸里放点"鱼浮灵",可使水中的含氧量迅速增加, "鱼浮灵"的化学名称是过氧碳酸钠(俗称固体双氧水,化学式2Na2CO3·3 H2O2).常温下, 过氧碳酸钠易溶于水并迅速放出氧气,能有效地提高水生动物的成活率.
①请设计实验验证"鱼浮灵"的供氧原理:
| 实验操作 |
现象 |
结论 |
②为证明"鱼浮灵"供氧后所得溶液的主要成分,还应补充实验:.
化学兴趣小组同学发现实验台上按如下顺序摆放着7瓶不同的无色溶液(如图所示),其中4、5号试剂瓶标签破损.
【提出问题】这两瓶试剂分别是什么
【查阅资料】
①碱性的亚硫酸钠
溶液、
溶液都能与中性的
溶液发生复分解反应,产生白色沉淀.
②
.
③
与
均可以使澄清石灰水变浑浊,
是一种有刺激性气味的气体.
【作出猜想】4、5号溶液可能分别是
或
溶液中的一种.
【实施方案】取少量4、5号溶液分别于试管中,然后分别进行下列三组实验.
实验1:在两支试管中分别滴入上述七种溶液中的号溶液,两试管中的溶液均变成红色,说明4、5号溶液均不可能是上述猜想中的溶液.
实验2:在两支试管中分别滴入上述七种溶液中的3号溶液,两试管中均产生白色沉淀,4、5号溶液可能分别是
溶液和
溶液中的一种.写出其中一个反应的化学方程式.
实验3:在两支试管中分别滴入上述七种溶液中的2号溶液,在盛4号溶液的试管中有现象,说明4号是
溶液;在盛5号溶液的试管中有
现象,说明5号是
溶液.
【实验反思】同学们经过分析,认为4号溶液还可能是变质的
溶液.请你利用上述图中的试剂设计鉴定实验方案,完成实验报告.
| 实验操作 |
实验现象 |
实验结论 |
|
|
|
4号溶液是部分变质的
溶液. |
小明同学想研究一氧化碳的还原性,通过查阅资料知道:草酸(H2C2O4)与浓硫酸混合加热会产生一氧化碳,反应方程式为:
。
于是他设计了下图的实验装置,结合装置回答下列问题: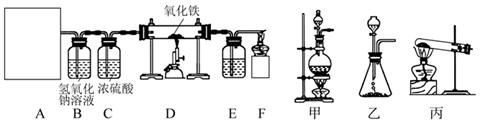
(1)图A是用草酸制取CO的反应装置,你认为应选择(填"甲"、"乙"或"丙")装置;(2)装置C的作用是;
(3)装置D中反应的化学方程式为;
(4)为检验装置D中产生的气体,E装置中的液体应为;
(5)装置F中酒精灯的作用是。
某化学兴趣小组的同学用下图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹。
(1)烧瓶中观察到的现象是。
(2)根据上述现象能否得出"二氧化碳与氢氧化钠发生了反应"的结论?原因是。
(3)实验结束后,兴趣小组提出新问题:烧瓶内液体的溶质可能是什么?
【猜想】猜想①:溶质只有氢氧化钠;
猜想②:溶质是氢氧化钠和氢氧化钙;
你还需补充的猜想:溶质是。
【设计实验】请你为这三种猜想设计实验验证方案
| 实验操作 |
预期现象及结论 |
年
月
日,包括圆明园兽首在内的一批珍贵文物首次在烟台展出。小霞看到这些
年前的铜质兽首后,她想探究铜是怎么冶炼出来的。
【查阅资料】
(1)冶炼铜可以用常见的铜矿石--孔雀石,其主要成分是碱式碳酸铜[
]。碱式碳酸铜是一种绿色的不溶于水的固体,加热易分解,能与酸反应。
,
。
(2)实验室可以用至少三种方法来制取铜:①用氢气在加热的条件下还原氧化铜(生成铜和水);②电解氯化铜溶液(生成铜和氯气,氯气有毒);③用活泼金属从铜的盐溶液中置换。
【设计方案】在实验室中以碱式碳酸铜、铁粉、稀盐酸为原料来制取铜。请你仿照下图①帮她画出另外两种制取铜的流程图。
①
②
③
【反思评价】
(1)上述三种制取铜的方案中,你认为最理想的是,与其他两种方案比较,它有哪些优点(至少答一点):。
(2)铜锈的主要成分也是碱式碳酸铜[
]。铜生锈除了与空气中的氧气和水关外,从碱式碳酸铜的化学式推知,还可能与空气中的有关。