在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O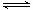 HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 | B.通入CO2, 平衡朝正反应方向移动 |
C.升高温度,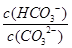 减小 减小 |
D.加入NaOH固体,溶液pH减小 |
下列生产或实验事实引出的相应结论不正确的是
| 选项 |
事实 |
结论 |
| A |
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 |
当其他条件不变时,升高反应温度,化学反应速率加快 |
| B |
工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 |
增大气液接触面积,使SO3的吸收速率增大 |
| C |
在容积可变的密闭容器中发生反应:2NH3(g) 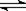 N2H4(l)+H2(g),把容积的体积缩小一半 N2H4(l)+H2(g),把容积的体积缩小一半 |
正反应速率加快,逆反应速率减慢 |
| D |
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 |
当其他条件不变时,催化剂可以改变化学反应速率 |
将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
| A.升高温度,气体颜色加深,则此反应为吸热反应 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
下列说法正确的是
| A.增大压强,单位体积活化分子数一定增加,化学反应速率一定增大 |
| B.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| C.加入反应物,使活化分子百分数增加,化学反应速率增大 |
| D.使用催化剂,一定降低了反应的活化能,化学反应速率一定增大 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ/mol;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ/mol则HCN在水溶液中电离的ΔH等于( )
| A.-67.7 kJ/mol | B.-43.5 kJ/mol |
| C.+43.5 kJ/mol | D.+67.7 kJ/mol |
某反应过程中体系的能量变化如图所示,下列说法错误的是
A.反应过程可表示为 |
| B.E1为反应物的平均能量与过渡态的能量差,称为正反应 的活化能 |
| C.正反应的热效应为ΔH=E1-E2<0,所以正反应为放热反应 |
| D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应 |