利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题: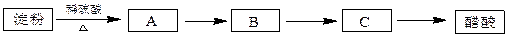
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
I、淀粉水解: , 反应。
II、B与醋酸反应: , 反应。
Ⅲ、B→C: , 反应。
(2)可用于检验淀粉水解是否产生A的试剂是 。]
检验所酿的陈醋中是否含有淀粉的方法是 。
化合物F的合成路线如下图所示。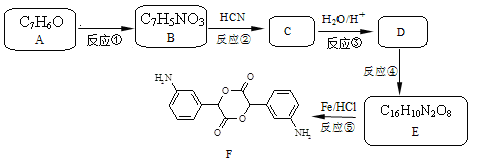

(1)写出反应类型:反应②;反应④。
(2)写出结构简式:B;E。
(3)在D转化为E的过程中可能生成了一种高分子化合物G,写D→G反应的化学方程式:。
(4)以下是由CH3CH=CHCOOH制备CH3CH=C(COOH)2的合成路线。
①写出Ⅲ的结构简式:;
②写出反应⑥的化学方程式:。
有机物A(C11H12O2)可用来调配果味香精,其合成路线如下: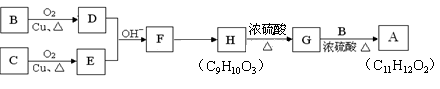
已知:①两个醛分子间能发生如下反应: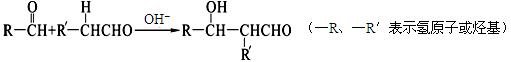
②C的分子式为C7H8O,能与钠反应,不与碱反应,也不能使Br2的CCl4溶液褪色。
(1)上述合成过程中,有机物没有涉及的反应类型有:(填写序号)。
a.酯化反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
(2)写出结构简式。C:; A:。
(3)H生成G的化学方程式:。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所
有同分异构体的结构简式。
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: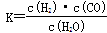 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度(mol/L) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)=
②比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向(填“逆向”、“正向”或“不”)移动,平衡常数K(填“增大”、“减小” 或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) →2NO (g) -180.8 kJ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的物质的量比为3:1。
(1)写出并配平上述化学方程式,标出电子转移方向与数目。
KMnO4 + H2S +H2SO4 →
在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:
KMnO4 + C +H2O →MnO2 + X +K2CO3(未配平)
(2)X的化学式为__________。
(3) 1mol氧化剂被______(填“氧化”或“还原”)时,生成_____mol氧化产物
工业上通常以铝土矿(主要成分为Al2O3)为原料制备无水氯化铝:2Al2O3+6Cl2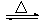 4AlCl3+3O2 ↑。请回答下列问题:
4AlCl3+3O2 ↑。请回答下列问题:
(1)上述反应涉及的元素中,最外层有2个未成对电子的元素是__________;简单离子的离子半径最小的元素,其原子核外有_____种不同能级的电子。
(2)已知元素周期表中,镓(31Ga)与铝元素同一主族,写出Ga的最外层电子排布式:______
(3)镓(Ga)有两种天然同位素,一种是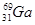 ,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
(4)为促进反应的进行,实际生产中需加入焦炭,其原因是。