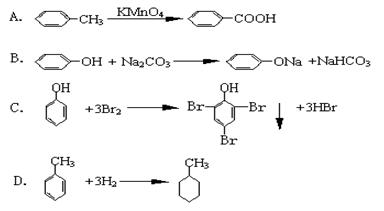
在下列叙述中,不能说明醋酸是弱电解质的是
| A.室温下,0.1mol·L-1的CH3COONa溶液的pH=8 |
| B.室温下,0.1mol·L-1的CH3COOH溶液的pH="3" |
| C.醋酸中加水后,溶液的pH升高 |
| D.0.1mol·L-1的CH3COOH导电能力不如0.1mol·L-1的盐酸强 |
某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的说法正确的是()。
| A.此干燥剂为混合物 | B.小纸袋中的物质可长期持续地做干燥剂 |
| C.其中钙元素的存在形态为游离态 | D.此干燥剂可以食用 |
下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图
上述试验过程中,所涉及的三次分离操作分别是
| A.①蒸馏②过滤③分液 | B.①分液②蒸馏③蒸馏 |
| C.①蒸馏②分液③分液 | D.①分液②蒸馏③结晶、过滤 |
食品香精菠萝酯的生产路线(反应条件略去)如下: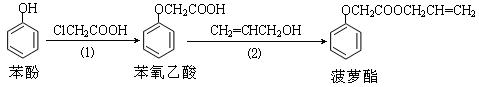
下列叙述错误的是
| A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验 |
| B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
| C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 |
| D.步骤(2)产物中残留的烯丙醇(CH2=CHCH2OH)可用溴水检验 |
下列文字表述与反应方程式对应且正确的是
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓ |
| B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑ |
C.苯酚钠溶液中通入足量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + CO32- 2C6H5OH + CO32- |
| D.实验室用液溴和苯在催化剂作用下制溴苯: |
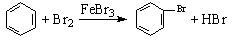
在苯和它的衍生物中, 由于侧链与苯环间的相互影响,从而使它们在性质上都发生了一些变化。但下列反应中不能够说明这一现象的是