下列离子方程式的书写正确的是
| A.误将洁厕灵与消毒液混合:2H++Cl-+ClO-=Cl2↑+H2O |
| B.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| C.高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
| D.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.18 g H2O中含NA个质子 |
| B.1 L 1 mol·L一1的CuSO4溶液中含NA个Cu2+ |
| C.常温常压下,2.24 L Cl2中含0.2NA个氯原子 |
| D.0.5 mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
下列工业生产的主要反应中,涉及置换反应的是
| A.制取粗硅 | B.海水提镁 | C.电解制铝 | D.制备硫酸 |
【化学——选修3:物质结构与性质】(15分)有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是___________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)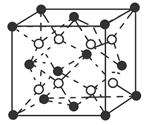
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下: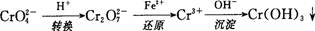
已知转化过程中的反应为2CrO42-(aq)+2H+(aq) Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 |
| D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
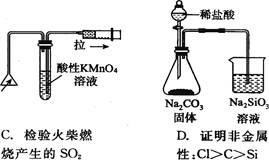
下列实验装置正确且能完成实验目的的是