下列解释实验现象的反应方程式正确的是
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2===Na2O2 |
| B.向Na2CO3溶液中滴加HCl溶液,立即有气体产生CO32-+2H+===H2O+CO2↑ |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物2Na2O2+2CO2===2Na2CO3+O2 |
| D.向NaHCO3溶液中逐滴加入澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙试液显红色的溶液:Na+、NH4+、Fe3+、NO3— |
| B.能使苯酚变紫色的溶液:K+、Mg2+、I-、SO42- |
| C.含Al3+的溶液:NH4+、K+、HCO3-、Cl- |
| D.水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu 2+、SO42-、NO3-、Cl- |
一定温度下,满足下列条件的溶液一定呈酸性的是
| A.能与金属Al反应放出H2的溶液 | B.加酚酞后显无色的溶液 |
| C.pH=6的某溶液 | D.c(H+)>c(OH—)的任意水溶液 |
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
化学与能源、环境、生产、生活密切相关,下列说法不正确的是
| A.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM 2.5污染 |
| B.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
| C.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但无净水作用 |
| D.可利用工业生产产生的二氧化碳制造全降解塑料 |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积(V)的变化,沉淀的总物质的量(n)的变化如右图所示。则下列说法中正确的是( )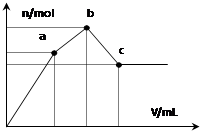
| A. a点的溶液呈中性 |
| B.b点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200mL |
| D.c点溶液呈碱性 |