(16分)用98%的浓硫酸(其密度为1.84g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,
(1)经计算,应用 (填仪器名称及规格,下同)取浓硫酸 。
(2)配制操作可分解成如下几步,以下正确的操作顺序是_____________________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需 __________、 __________。
(4)玻璃棒在整个实验中的作用是 、 。
(5)由于错误操作, 使得到的浓度数据比正确的偏大的是___________________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配 好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为________(填字母)。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是__________________________。
②在配制硫酸亚铁溶液时,需加入铁粉的理由是__________________________。
Ⅱ.标定FeSO4溶液的浓度
(1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为______________,据此可测得FeSO4溶液的物质的量浓度为________mol·L-1。
(2)滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂,填字母)为指示剂,滴定终点颜色变化是_________________________________。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式。
(2)实验前必须对整套装置进行的操作是。
(3)硬质玻璃管中石棉绒的主要作用是。
(4)干燥管中盛装的物质可以是
(5)点燃酒精灯和酒精喷灯的先后顺序是
实验室制NO及验证NO的性质,可以用如图所示的装置。请根据提示完成以下问题。已知反应:

1.NO的制备
(1)在加药品之前首先应进行的操作是(填操作名称),
(2)打开阀门K,取下活塞J向其中加入一小片铜片,装上活塞并推至底部。
(3)用注射器吸取适量的蒸馏水,然后倒立针筒,推动活塞J至底部以排尽装置内空气(装置内极少量的水不影响实验)。
(4)将注射器插入稀 中,吸取适量的稀
中,吸取适量的稀 ,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:。
,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:。
反应的离子方程式为:,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
Ⅱ.NO性质实验
(1)观察注射器内气体呈色,然后打开K,吸取适量空气后关闭K,此时注射器内气体呈色,反应的化学方程式为:。
(2)向下快速推动活塞J,注射器内气体颜色变化情况为:,原因是
(结合化学方程式并配以必要的文字说明)。
(15分) Ⅰ、某同学用下图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2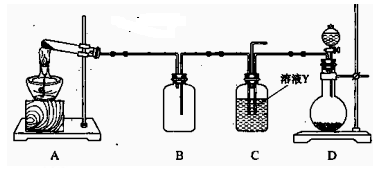
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为(用药品序号填
空,下同);装置D处固体药品的最佳选择为(用药品序号填空)。
(2)下列各项制备实验中,也可利用装置D处仪器完成的是(填序号)。
| A.MnO2与浓盐酸反应制备Cl2 | B.Cu与浓硫酸反应生成SO2 |
| C.由H2O2分解制O2 | D.乙醇与乙酸反应制备乙酸乙酯 |
E.Zn与稀硫酸反应制备H2
(3)写出上述装置A处的试管中所发生反应的化学方程式:
。
Ⅱ、甲同学利用下图所示装置探究SO2和Cl2两种气体按不同比例混合后的漂白性。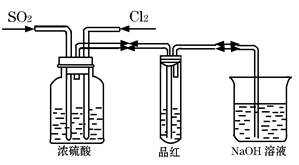
试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: (结合反应方程式)。
Ⅰ、下列说法不正确的是。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
E.浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处
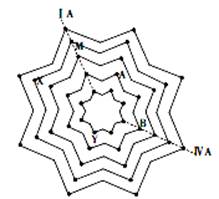
Ⅱ、某同学在学习元素周期表后,将第二至第六周期的主族和零族元素排列成“八角星”元素周期表(如图),图中每个“·”代表一种元素,每个“八角星”代表一个周期,元素X核外有5个电子层。试写出M的元素符号是,元素Y的原子结构示意图为。