将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)  2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| |
改变条件 |
新平衡与原平衡比较 |
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |
室温时,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
| A.V(酸)=102V(碱) | B.V(碱)=102V(酸) |
| C.V(酸)=2V(碱) | D.V(碱)=2V(酸) |
水的电离过程为H2O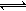 H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
| A.c(H+)随着温度的升高而降低 | B.在35℃时,纯水中 c(H+) >c(OH-) |
| C.水的电离常数K(25℃)>K(35℃) | D.水的电离是一个吸热过程 |
有一处于平衡状态的反应:A(g)+3D(g) 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
| A.①、③和⑥ | B.②、③和⑥ | C.①、④和⑥ | D.②、③、⑤和⑥ |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)  2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
| A.40% | B.50% | C.60% | D.70% |