某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
① pH试纸检验,溶液的pH > 7。
② 取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③ 另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。
④ 向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。
⑤ 在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。
则关于原溶液的判断中不正确的是( )
| A.肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤 ④ 改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。 |
已知:C(s)+H2O(g) CO(g)+H2(g)ΔH =" +130" kJ·mol-1
CO(g)+H2(g)ΔH =" +130" kJ·mol-1
2C(s)+O2(g) 2CO(g)ΔH="a" kJ·mol-1
2CO(g)ΔH="a" kJ·mol-1
H—H、O O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
| A.-332 | B.-118 | C.-220 | D.+350 |
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
| A.该电池的负极反应式为:CH3CH2OH+ 3H2O-12e-===2CO2↑+12H+ |
| B.该电池的正极反应式为:O2+4e-+4H+===2H2O |
| C.电流由O2所在的铂电极经外电路流向另一电极 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
下列用来表示物质变化的化学用语中,正确的是
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- = Cu2+ |
| D.钢铁发生电化学腐蚀时,正极反应式:Fe-2e- =Fe2+ |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
| A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e—+ 5OH—=FeO42-+ 4H2O |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g) + O2(g) 
 2SO3(g),
2SO3(g),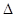 H=-197 kJ/mol。下列说法正确的是
H=-197 kJ/mol。下列说法正确的是
| A.使用催化剂可以提高SO2的转化率 |
| B.增大O2的浓度可以提高反应速率和SO2的转化率 |
| C.反应450℃时的平衡常数小于500℃时的平衡常数 |
| D.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动 |