已知反应式:①H2S+I2====S↓+2H++2I-
②H2SO3+2H2S====3S↓+3H2O ③2I-+Br2I2+2Br-④H2SO3+I2+H2O====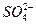 +2I-+4H+,下列各组中还原性由强到弱的是( )
+2I-+4H+,下列各组中还原性由强到弱的是( )
| A.H2S、H2SO3、I-、Br- |
| B.I-、Br-、H2SO3、H2S |
| C.H2S、I-、Br-、H2SO3 |
| D.I-、Br-、H2S、H2SO3 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2(g) +O2(g) △H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) +O2(g) △H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
100 0 |
150 0 |
| c(N2O5)/mol•L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.500s内N2O5分解速率为2.96×10-3mol•L-1•s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)>5.00mol•L-1
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
N2(g)+3H2(g) 2NH3(g) △H<0,当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0,当反应达到平衡时,下列措施能提高N2转化率的是
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压
| A.③④ | B.①② | C.②③ | D.①④ |
在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: 2NO(g)+C(g) N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0.70 |
|
| T2 |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
| 选项 |
操作及现象 |
溶液 |
| A |
通入CO2,溶液变浑浊 |
饱和Na2CO3溶液 |
| B |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
Na2SiO3溶液 |
| C |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
| D |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
澄清石灰水 |
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是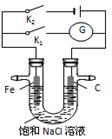
| A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |