已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中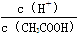 值增大,可以采取的措施是
值增大,可以采取的措施是
| A.加少量烧碱固体 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |
下列有机物命名正确的是
A. 1,3,4--三甲苯 1,3,4--三甲苯 |
B. 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
C. 2-甲基-1-丙醇 2-甲基-1-丙醇 |
D. 2-甲基-3-丁炔 2-甲基-3-丁炔 |
下列反应中前者属于取代反应,后者属于加成反应的是
| A.光照甲烷与氯气的混和物;乙烯使酸性高锰酸钾溶液褪色 |
| B.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 |
| C.苯滴入浓硝酸和浓硫酸的混合液中水浴加热;乙烯与水蒸汽在一定条件下生成乙醇 |
| D.在苯中滴入溴水,“水层褪色;乙烯使溴水褪色 |
下列有关有机物的说法正确的是
| A.石油经过分馏及裂化等工序炼制后即可得到纯净物 |
| B.2,4—二甲基—3—戊醇经消去反应所得产物名称为:2,4—二甲基—3—戊烯 |
| C.苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D.红外光谱与核磁共振氢谱可以用于确定有机物的官能团和结构式 |
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NH3·H2O溶液中:c(NH4+)<c(OH-) |
| B.0.1 mol·L-1NH4C1溶液中:c(NH4+)+c(H+)==c(Cl-)+c(OH-) |
| C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+c(H2CO3)="0.1" mol·L-1 |
| D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4,NH4HSO4溶液,c(NH4+)大小顺序: |
CH3COONH4>NH4Cl>NH4HSO4