下列实验事实所引出的相应结论正确的是
| 选项 |
实验事实 |
结论 |
| A |
Na2S2O3溶液与稀H2SO4溶液混合时,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 |
当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B |
在化学反应前后,催化剂的质量和化学性质都没有发生改变 |
催化剂一定不参加化学反应 |
| C |
将NH4Cl晶体与Ba(OH)2.8H2O晶体混合后研磨,烧杯壁温度降低 |
该反应为吸热反应 |
| D |
在容积可变的密闭容器中发生反应 H2(g)+ I2(g) 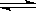 2HI(g), 2HI(g),把容积缩小一倍 |
正反应速率加快,逆反应速率不变 |
25℃时的下列五种溶液中,水的电离程度由大到小排列顺序正确的是
| 溶质 |
HCl(aq) |
FeCl3 |
NaOH |
HCOONa |
C2H5OH |
| 溶液的pH |
3 |
4 |
10 |
11 |
未测定 |
| 水的电离程度 |
α1 |
α2 |
 α3 α3 |
α4 |
α5 |
A.α3>α1>α5>α4>α2 B.α4>α2>α5>α3>α1
C.α2>α4>α5>α1>α3 D.α1>α3>α5>α2>α4
已知热化学反应方程式:
Zn(s)+ O2(g)
O2(g) ZnO(s);ΔH="-351.5" kJ·mol-1
ZnO(s);ΔH="-351.5" kJ·mol-1
Hg(l)+ O2(g)
O2(g)  HgO(s);ΔH
HgO(s);ΔH  ="-90.84" kJ·mol-1
="-90.84" kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)  ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
| A.ΔH="+260.7" kJ·mol-1 | B.ΔH="-260.7" kJ·mol-1 |
| C.ΔH="-444.2" kJ·mol-1 | D.ΔH="+444.2" kJ·mol-1 |
一定温度下,在密闭容器中可逆反应.N2(g)+3H2(g)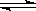 2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡时体系的压强为反应前的()
2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡时体系的压强为反应前的()
| A.1/5 | B.3/4 | C.9/11 | D.1/2 |
下列热化学方程式中,△H能正确表示物质的燃烧热的是()
A.CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B C(s) +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
+1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
C. H2(g) + 1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25 O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
下列图像能正确反映所对应实验的是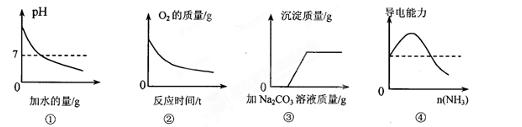
| A.①为向pH=13的NaOH溶液中不断加水 |
B. ②为向MnO2中加入一定量的H2O2溶液 ②为向MnO2中加入一定量的H2O2溶液 |
| C.③为向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.④为将氨气通入醋酸溶液中 |