常温下,0.1 mol/L某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.HA为强酸
B.溶液中c(H+)+c(A—)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体,溶液的c(OH—)增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A—)>c(Na+)>c(OH—)>c(H+)
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于
Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是
A WX4是沼气的主要成分 B固态X2Y是分子晶体
C ZW是原子晶体 D ZY2的水溶液俗称“水玻璃”
能用键能大小解释的是
A N2的化学性质比O2稳定得多 B常温常压下,溴呈液态,碘呈固态
C 稀有气体一般很难发生化学反应 D硝酸易挥发而磷酸难挥发
下列离子方程式中,正确的是
A.向氯化亚铁溶液中通入氯气 Fe2++Cl2Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3·H2OFe(OH)3↓+3NH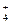
C碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+Ca2++2H2O+2CO2↑
D氯气通入冷的氢氧化钠溶液中2Cl2+2OH-3Cl-+ClO-+H2O
有关晶体的下列说法中正确的是
A 氯化钠熔化时离子键未被破坏 B 原子晶体中共价键越强,熔点越高
C 冰融化时水分子中共价键发生断裂 D 晶体中分子间作用力越大,分子越稳定
下面关于SiO2晶体网状结构的叙述正确的是
| A.存在四面体结构单元,O处于中心,Si处于4个顶角 |
| B.最小的环上,有3个Si原子和3个O原子 |
| C.最小的环上,Si和O原子数之比为1:2 |
| D.最小的环上,有6个Si原子和6个O原子 |