“太湖蓝藻事件”为我们生存的环境敲响了警钟。2007年5月29日,江苏省无锡市的自来水水质骤然恶化,气味难闻,无法正常饮用。原因是无锡市唯一的饮用水取水源--太湖暴发了大量蓝藻。蓝藻是一种常于夏季大量繁殖的藻类,腐败死亡后在水面形成一层蓝绿色而有腥臭味的浮沫,称为“水华”。关于蓝藻危害爆发的原因是: ( )
| A.化石燃料的燃烧造成的污染。 | B.工矿企业排放了大量含有重金属离子的有毒污水。 |
| C.臭氧层空洞使蓝藻生长加速。 | D.大量工业生活污水排放使水体营养化。 |
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(1)甲、乙、丙三个装置中共同发生反应的离子方程式是 。
(2)和甲装置相比,乙装置的优点是 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满试管②。
(4)当气体充满试管②后,将铜丝提起与溶液脱离,欲使烧杯中的水进人试管②,应进行的操作是 。
向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是()
A.Va=Vb时:c(CH3COOH) +c(CH3COO-)=c(K+) |
B.Va=Vb时:c(CH3COOH) +c(H+)=c(OH-) |
C.Va<Vb时:c (CH3COO-)>c(K+)> c(OH-)> c(H+) |
D.Va与Vb任意比时:c(K+)+ c (H+)=c(OH–)+ c(CH3CO–) |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应方程式为:2Cu+H2O==Cu2O+H2 。下列说法正确的是()
。下列说法正确的是()

A.石墨电极接直流电源的正极 |
B.铜电极发生的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
C.铜电极接直流电源的负极 |
D.当有0.1mol电子转移时,有0.1molCu2O生成。 |
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是()
A. ; ;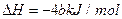 |
B. ; ; |
C. ; ; |
D. ; ;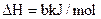 |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+=2Fe3++2H2O, ②2Fe3++H2O2=2Fe2++O2↑+2H+。下列说法不正确的是()
| A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强 |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
| C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变 |
| D.H2O2生产过程要严格避免混入Fe2+ |