写出下列反应的热化学方程式:
(1)已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,写出能表示该反应燃烧热的热化学方程式
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出445kJ的热量。____________________________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、
c kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________
(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。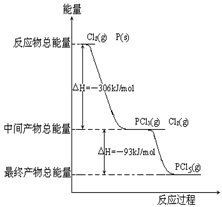
①P和Cl2反应生成PCl3的热化学方程式
②PCl5分解成PCl3和Cl2的热化学方程式_______________________
Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2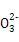 +I2
+I2 S4
S4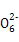 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I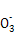 +5S
+5S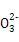 +2H+
+2H+ I2+5S
I2+5S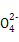 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL |
0.01 mol/LNa2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度/℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
该实验的目的是;表中V2=mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O Ce(OH)4↓+。
Ce(OH)4↓+。
氯化铁是常见的水处理剂,无水FeCl3易升华。工业上制备无水FeCl3的一种工艺如图所示:
(1)加入吸收塔的吸收剂X应是(填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5 mL饱和FeCl3溶液滴入50 mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入且保持过量,然后进行的操作依次为、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为。
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+ Fe2++Cr3+
Fe2++Cr3+
则电池放电时,Cl-将移向极(填“正”或“负”);充电时,阴极的电极反应式为。
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题:
(1)A与B可反应,产物中阳离子的结构式为。
(2)A与B的沸点比较,较高的是(写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式:。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式:。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式:。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于处。若X为锌,开关K置于M处,该电化学防护法称为。
几种中学化学常见的单质及其化合物相互转化的关系图如下: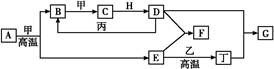
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为,每反应1 mol的A转移的电子为mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
试将①、②、③三个序号以及对应的分散质具体的化学式填入下列方框中: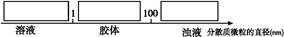
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:。
某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如下实验。
实验Ⅰ:
(1)无色气体为。
(2)该固体混合物的成分为。
实验Ⅱ:取一定量的该固体混合物溶于水配成1 L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示。
| Cl2的体积 (标准状况下)/L |
2.8 |
5.6 |
11.2 |
| n(A-)/mol |
1.25 |
1.5 |
2 |
| n(B-)/mol |
1.5 |
1.4 |
0.9 |
| n(C-)/mol |
a |
0 |
0 |
(3)a=。
(4)原固体混合物中各组成成分的物质的量之比为。