已知:①氯代烃在一定条件下能水解, (R为烃基,X表示卤原子)②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:R—NO2+3Fe+6HCl
(R为烃基,X表示卤原子)②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:R—NO2+3Fe+6HCl R—NH2+3FeCl2+2H2O对乙酰氨基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:
R—NH2+3FeCl2+2H2O对乙酰氨基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:
请回答下列问题:
(1)写出反应的方程式由氯苯制A
由A制B
由B制C
(2)扑热息痛在潮湿的环境中长期受热能发生水解,写出扑热息痛水解的化学方程式。
(3)写出与扑热息痛互为同分异构体、分子中含有苯环的氨基酸的结构式。
今有化合物: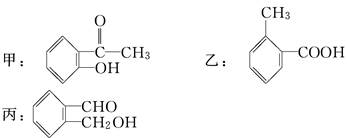
(1)请写出丙中含氧官能团的名称________.
(2)上述化合物中互为同分异构体的是________.
某学生写出如下十种一氯戊烷的同分异构体: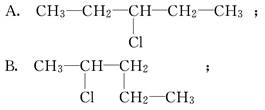
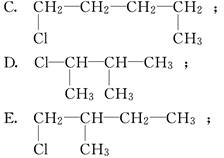
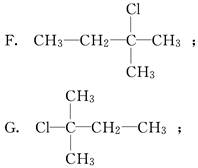
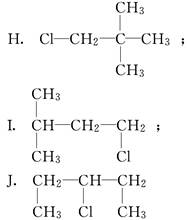
(1)你认为一氯戊烷共有________种同分异构体.
(2)上述十种结构中,属于同种分子的是______________________(填序号).
下列是一个化工产品生产过程设计框图,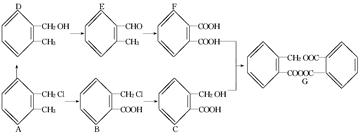
根据要求回答下列各题.
(1)只含有一种官能团的物质是________.
(2)含有羧基的是____________.
(3)写出G物质的分子式____________.
降冰片烯的分子结构如图:
(1)降冰片烯的分子式为________.
(2)降冰片烯分子中含有的官能团为________(写名称).
(3)降冰片烯属于________(填序号).
A.环状化合物 B.芳香化合物 C.链状化合物
根据下列有机化合物填空.
(1)①可以看作醇类的是________(填写序号,下同);
②可以看作酚类的是________;
③可以看作羧酸类的是________;
④可以看作酯类的是________.
(2)请写出b中所含官能团的结构简式________.