(6分)按要求写出相应的方程式:电离方程式:
(1) H2S:____________________________。
(2) NH4HSO4____________________________。
水解反应的离子方程式:
(1) CuSO4____________________________。
(2) Na2CO3____________________________。
(3) AlCl3+Na2S____________________________。
某氮肥厂氨氮废水中的氮元素多以
和
的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加
溶液,调节
至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加
溶液的作用:。
②用化学平衡原理解释通空气的目的:。
(2)过程Ⅱ:在微生物作用的条件下,
经过两步反应被氧化成
。两步反应的能量变化示意图如下:
①第一步反应是反应(选题"放热"或"吸热"),判断依据是。
②1
全部氧化成
的热化学方程式是。
(3)过程Ⅲ:一定条件下,向废水中加入
,将
还原成。若该反应消耗
转移6
电子,则参加反应的还原剂和氧化剂的物质的量之比是。
由短周期元素组成的化合物
是某抗酸药的有效成分。甲同学欲探究
的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②
在
=5.0时沉淀完全;
在
=8.8时开始沉淀,在
=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物
粉末中加入过量盐酸,产生气体
,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节
至5~6,产生白色沉淀
,过滤。
Ⅳ.向沉淀
中加过量
溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加
溶液,调节
至12,得到白色沉淀
。
(1)Ⅰ中气体
可使澄清石灰水变浑浊,
的化学式是。
(2)由Ⅰ、Ⅱ判断
一定不含有的元素是磷、。
(3)Ⅲ中生成
的离子方程式是。
(4)Ⅳ中
溶解的离子方程式是。
(5)沉淀
的化学式是。
(6)若上述
:
:
=1:2:3,则
的化学式是。
是新型降压药替米沙坦的中间体,可由下列路线合成:
(1)
的反应类型是,
的反应类型是,
的反应类型是。
(2)写出满足下列条件的B的所有同分异构体(写结构简式)。
①含有苯环②含有酯基③能与新制
反应
(3)
中含有的官能团名称是。已知固体
在加热条件下可溶于甲醇,下列
的有关说法正确的是。
a.使用过量的甲醇,是为了提高D的产率 b.浓硫酸的吸水性可能会导致溶液变黑
c. 甲醇既是反应物,又是溶剂 d. D的化学式为
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是(写结构简式)。
(5)已知 在一定条件下可水解为
在一定条件下可水解为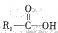 和
和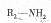 ,则F在强酸和长时间加热条件下发生水解反应的化学方程式是。
,则F在强酸和长时间加热条件下发生水解反应的化学方程式是。
、
、
、
是元素周期表前四周期中的四种常见元素,其相关信息如下表;
| 元素 |
相关信息 |
|
的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
| 常温常压下,
单质是淡黄色固体,常在火山口附近沉积 |
|
| 和 同周期, 的电负性大于 | |
| 的一种核素的质量数为63,中子数为34 |
(1)
位于元素周期表第周期第)族,
和
最高价氧合物对应的水化物的酸性较强的是(化学式)
(2
是一种常用的溶剂,
的分子中存在个
键。在
,
两种共价键中,键的极性较强的是,键长较长的是。
(3)
的基态原子核外电子排布式是。
在空气中煅烧生成的
化学方程式是。
(4)处理含
验到气污染的一种方法,是将其在催化剂作用下转化为单质
。
已知:
此反应的热化学方程式是
、
、
、
、
五种元素的原子序数依次增大。
、
、
、
是组成蛋白质的基础元素,
是地壳中含量最高的金属元素。
回答下列问题:
⑴
的元素符号为 ;
在元素周期表中的位置为;五种元素的原子半径从大到小的顺序是(用元素符号表示)。
⑵
、
两元素按原子数目比l∶3和2∶4构成分子
和
,
的电子式为,
的结构式为。
⑶ 硒(
)是人体必需的微量元素,与
同一主族,
原子比
原子多两个电子层,则
的原子序数为,其最高价氧化物对应的水化物化学式为。该族2 ~ 5周期元素单质分别与
反应生成l
气态氢化物的反应热如下,表示生成1
硒化氢反应热的是(填字母代号)。
a.+99.7
b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用
单质 作阳极,石墨作阴极,
溶液作电解液进行电解,生成难溶物
,
受热分解生成化合物
。写出阳极生成
的电极反应式;由
生成
的化学方程式:。
作阳极,石墨作阴极,
溶液作电解液进行电解,生成难溶物
,
受热分解生成化合物
。写出阳极生成
的电极反应式;由
生成
的化学方程式:。