氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 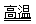 2 AlN + 3 CO ,则下列叙述正确的是
2 AlN + 3 CO ,则下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1molAlN需转移3mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |
下列气体不可以用浓硫酸干燥的是
| A.H2 | B.NH3 | C.SO2 | D.Cl2 |
下列变化中必须加入还原剂才能实现的是
| A.MnO4- →Mn2+ | B.HCl →Cl2 |
| C.Fe →Fe3+ | D.KClO3→O2 |
下列离子方程式中正确的是
| A.稀硫酸滴加在铜片上:Cu +2H+ =Cu2+ +H2↑ |
| B.氧化铁粉末溶于稀盐酸:Fe2O3 + 6H+ =2Fe3+ + 3H2O |
| C.硫酸滴加到氢氧化钡溶液中:H+ + OH- =H2O |
| D.碳酸氢钠和盐酸反应:CO32- +2H+ =CO2↑+H2O |
在溶液中能够大量共存的离子组是
| A.Ca2+、Cl-、CO32-、Na+ | B.Cl-、CO32-、Na+ 、H+ |
| C.H+、Ba2+、OH-、NO3- | D.Mg2+、Na+、Cl-、SO42- |
下列各组物质中,所含分子数相同的是
| A.10gH2和10gO2 | B.5.6LN2(标准状况)和11gCO2 |
| C.11.2L(标准状况)水和0.5molBr2 | D.224mlH2和0.1molN2 |