下列有关以KOH溶液为电解液的氢氧燃料电池的叙述不正确的是
| A.正极反应式为:O2 + 2H2O +4e- =4OH- |
| B.工作一段时间后,电解液中KOH的物质的量浓度不变 |
| C.该燃料电池的总反应式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.2mol电子转移 |
已知25℃时,0.l mol/L的碳酸氢钠溶液的pH为8.4,则关于该溶液的叙述错误的是
| A.滴加甲基橙溶液呈黄色 | B.c(HCO3-)>c(H2CO3)>c(CO32-) |
| C.c(OH-)=c(H+)+c( H2CO3)-c (CO32-) | D.加水稀释,c( H2CO3)/c(HCO3-)的比值减小 |
某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl-、NO3-六种离子中的几种。进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中肯定不能大量存在的离子是
| A.I- | B.HCO3- | C.Fe2+ | D.NO3- |
对以下反应的产物判断正确的是
| A.H2S与湿的醋酸铅试纸:生成硫化铅和醋酸 |
| B.SO2与氨水:生成的铵盐肯定只有一种 |
| C.CO2与NaClO溶液:生成的钠盐肯定只有一种 |
| D.NO2、NO与NaOH溶液:生成的钠盐肯定只存一种 |
主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是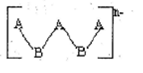
A.n=2 B.A是第ⅡA族元素
C.A为-2价,B为+2价 D.该离子没有还原性
FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-的形式存在。若有l mol FeS2“溶解”,则生成H2SO4的物质的量为
| A.2mol | B.4 mol | C.6 mol | D.8 mol |