在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为( )
| A.1∶1∶1 | B.2∶2∶1 | C.2∶3∶1 | D.4∶3∶2 |
下列关于能量变化的说法正确的是
| A.冰融化成水放出热量 |
| B.化学键断裂过程一定放出能量 |
| C.生成物的总能量一定低于反应物的总能量 |
| D.化学键的断裂和形成是化学反应中能量变化的主要原因 |
图是产生和收集气体的实验装置,该装置适合于 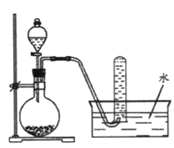
| A.用浓硝酸与Cu反应制取NO2 |
| B.用浓盐酸和MnO2反应制取Cl2 |
| C.用NH4Cl溶液和Ca(OH)2反应制取NH3 |
| D.用H2O2溶液和MnO2反应制取O2 |
下列反应结束后,向其中滴加KSCN溶液,溶液变成血红色的是
| A.铁锈与过量稀盐酸 | B.FeCl3溶液与过量铜片 |
| C.FeCl3溶液与过量铁粉 | D.FeCl2溶液与过量Zn粉 |
将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为
| A.Ag+ + e—===Ag | B.Cu — 2e—===Cu2+ |
| C.Cu2+ + 2e—===Cu | D.2H+ + 2e—===H2↑ |
在一定条件下,可逆反应2N2O5(g)⇌4NO2(g)+ O2(g)中,的物质的量浓度c(NO2)随时间变化的实验数据如下表所示:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| c(NO2)/(mol·L-1) |
0 |
0.020 |
0.032 |
0.038 |
0.040 |
0.040 |
根据表中数据,该反应达到平衡时c(NO2)为
A.0.020mol·L-1 B.0.032mol·L-1 C.0.038mol·L-1 D.0.040mol·L-1